On a la réaction: H2O + HCl
On écrira alors deux relations qu'on retrouvera SYSTEMATIQUEMENT dans TOUT CALCUL DE pH.
II.3. Les pH des solutions aqueuses simples.
Retour
au plan du cours sur les pH des solutions aqueuses.
II.3.a. Cas d'un monoacide fort.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra le cas du chlorure
d'hydrogèneHCl dissous dans l'eau: la solution d' acide chlorhydrique.
On a la réaction:
H2O + HCl ![]() H3O+ + Cl-.
H3O+ + Cl-.
On écrira alors
deux
relations qu'on retrouvera
SYSTEMATIQUEMENT dans TOUT CALCUL
DE pH.
Il s'agit premièrement de l'équation de conservation de la masse, de conservation de la matière pour l'espèce considérée.
On aura, dans le cas de l'acide
chlorhydrique :
Cacide chlorhydrique global=
(HCl)non dissocié + (HCl)dissocié.
Or, (HCl)non dissocié
vaut 0, puisque
HCl
est un acide fort. Et (Cl-)
vaut alors
C0mol.L-1.
Il s'agit deuxièmement de l'équation de conservation de la charge, appelée aussi "bilan électrique" ou , le plus souvent, "électroneutralité".
Ici on aura: (H3O+) = (Cl-) + (HO-)
On adoptera, dès lors,
dans
toute la suite du cours, la convention d'écriture
beaucoup
plus légère qui est:
h
= (H3O+) w
= (HO-)
On peut tout de suite négligerwdevant
h,
vu qu'on a toutes les raisons à s'attendre à ce que le
pH d'un acide soit... acide.
On arrive donc à
(H3O+)
@C0,
d'où pH = - logh = -logC0.
Cette formule a un domaine de validité tant que la concentration C0 est supérieure ou égale à 10-6mol.L-1.
Si la concentration C0 a une valeur inférieure à 10-6 mol.L-1. Que se passe t-il alors?
C'est un cas qui n'est, je dirais,
qu'académique. C'est une question "piège" à
certains oraux de concours, à certains écrits, pour tester
la sagacité de l'étudiant, mais cette question n'a que
cet
"intérêt".
En effet, je me permets cette réflexion
"iconoclaste" car faire des dilutions aussi fortes dans une eau
qui, la plupart du temps n'est pas à pH 7 du fait de la
présence de dioxyde de carbone dissous, et chercher une variation
très infime par rapport à la "neutralité" c'est vraiment
pas "tenable". C'est l'expérimentateur qui parle.
Revenons à l'exemple académique.
Il faut alors résoudre
en
tenant compte des ions de l'eau, bref, de l'équilibre
d'autoprotolyse de l'eau.
On demande par exemple le pH
d'une
solution d'acide chlorhydrique à 10-8mol.L-1.
Si l'on est trop "pressé"
on peut se jeter dans la gueule du "loup" et répondre:"Le pH vaut
-log10-8
, soit.... 8!!!! "
Enfer et damnation!!!!! Le pH d'un acide est tout d'un coup ... basique!!!!
What happened? Qué paso?
On écrit la conservation
de la matière:
10-8 mol.L-1=
(Cl-) + (HCl)non dissocié
(HCl)non dissocié
vaut 0 mol.L-1.
On écrit l'électroneutralité
de la solution:
Quand je vous disais que ce pH est "académique".....
A titre d'exercice on peut chercher le pH d'une solution d'acide chlorhydrique à 10-7mol.L-1.
Retour au plan du cours sur les pH des solutions aqueuses.
II. 3.b. Cas d'une monobase forte.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra le cas de l'hydroxyde
de sodium, de formule
NaOH, qu'on dissoudra à raison
de
C0mol.L-1.
On a la réaction de dissolution
dans l'eau suivante:
NaOH ![]() Na+ + HO-
Na+ + HO-
Comme la mise en solution conduit
à ce que la réaction précédente soit totale,
on se retrouve alors avec w
qui vaut C0 mol.L-1.
Or, on a h qui vaut: ![]() . En remplaçant w par C0
on arrive alors, très facilement, en prenant le logarithme de l'expression,
à:
. En remplaçant w par C0
on arrive alors, très facilement, en prenant le logarithme de l'expression,
à:
On retrouve un raisonnement symétrique à celui évoqué lors de la question "académique" du pH d'une solution d'acide chlorhydrique à 10-8 mol.L-1.
Si l'on considère le calcul
du pH d'une solution d'
hydroxyde de sodium à 10-8
mol.L-1 et que l'on élimine la solution pH = 6
que donnerait une utilisation peu "raisonnable " de pH = 14
+ logC0, on arrive alors à l'équation d'électroneutralité
suivante : (Na+) + h =
w
= ![]() .
.
On a (Na+) qui vaut
C0,
soit 10-8 mol.L-1.
On résout l'équation
du second degré en
h qui a la forme suivante:
Retour au plan du cours sur les pH des solutions aqueuses.
II.3.c. Cas d'un monoacide faible.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra l'exemple de l'acide
acétique,
alias éthanoïque, de formule
CH3CO2H,
abrégé en "AcOH", où le radical "Ac"
désigne le radical "éthanoyle" alias "acétyle",
de formule "CH3CO-".
C'est là une abréviationque
l'on rencontre très souvent dans les ouvrages anglo-saxons,
et qui a la commodité d'être dactylographiée
aisément.
L'anion conjugué de l'acide
acétique
sera l'anion "acétate" , alias "éthanoate",
de formule CH3CO2-, abrégé
en "AcO-".
Le pKa du couple
acide acétique / anion acétate vaut 4.75
à 25 °C.
On se placera dans le cas
le plus intéressant
qui est celui où la concentration
C0de
l'acide
acétique est ³ 10-6mol.L-1.
On écrira l'équation chimique qui a lieu:
On peut encore vérifier a posteriori que les ions hydronium H3O+provenant de l'eau étaient négligeables devant ceux apportés par l'acide acétique lui même mis en solution. En effet, d'un côté nous avons 1.32.10-3 mol.L-1 et de l'autre nous avons quelque chose comme 10-7mol.L-1.
D'autre part, si nous recherchons
la "réaction prépondérante" nous retrouvons
bien qu'elle est celle relative à la dissociation de l'acide
acétique. La valeur de la constante d'équilibre vaut 10-4.75,
elle est
beaucoup plus grande que 10-14.
D'autre part, en s'intéressant
au bilan de matière produit par la réaction censée
être prépondérante
on voit bien que 1.325.10-3
mol est beaucoup plus grand que 10-7mol, ces 10-7
mol
devenant, du coup, négligeables.
J'ouvre à nouveau une parenthèse de taille, qui a son "importance", si j'ose dire, avec la question du "diagramme des espèces dissoutes".
La connaissance de ce diagramme
permettra éventuellement de faire des "simplifications" dans
les calculs. Il existe en effet des "formules approchées"
de calcul de pH.
Je n'en ressens pas forcément
l'utilité en toutes circonstances car j'estime que la résolution
d'une équation du second degré est bien "facile" et
surtout très souvent "suffisante" pour mener à bien
tout calcul de pH. Je donne malgré tout la "méthode"
des formules approchées pour les "inconditionnels".
Il faut donc tracer ici,
en
fonction du pH (la variable) , de pKa (le paramètre)
et de C0, l'évolution
des concentrations
respectives des formes moléculaire AcOH et ioniséeAcO-
des espèces dissoutes de l'acide acétique.
On a la constante d'acidité
Ka
du couple acide acétique / ion acétate qui s'écrit
:![]() .
.
On écrit l'équation
de conservation de la matière :
C0 =
(AcOH) + (AcO-)
On peut écrire l'électroneutralité
si on veut mais ici ça ne nous servira à rien.
De l'expression précédente
de Ka on tire (AcOH).
On a (AcOH) qui vaut: ![]()
A partir de là on écrit
la "trivialité" suivante:
(AcO-) = ![]()
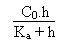
On peut les réarranger,
voire les exprimer d'une façon encore plus générale.
On réintroduit la notion
de
degré de dissociation a:
a
sera égal à : ![]()
En introduisant a
on s'affranchit de la concentration
C0.
On exprime Ka
et
h sous une
forme exponentielle:
On a Ka
= 10-pKa et h = 10-pH.
Les deux expressions de (AcO-)
et de (AcOH), devenues dès lors, respectivement, a
et 100-a deviennent dès
lors:
Pour a,
relatif
à l'évolution au cours de la variation
(tout
à fait éventuelle, provoquée si besoin par l'expérimentateur)
du pH de la formeAcO-: 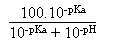 .
.
Pour 100 - a,
relatif
à
l'évolution (tout à fait éventuelle,
provoquée si besoin par l'expérimentateur)au cours de la
variation
du pH de la forme AcOH:![]() .
.
On peut, dès lors, tracer
l'allure des deux fonctions mathématiques décrivant l'évolution
des formes AcOH et AcO- dans le milieu.
On devine aisément que si
le pH augmente la forme AcOH régressera et qu'aucontraire
la
forme
AcO-augmentera.
On obtient le graphe suivant: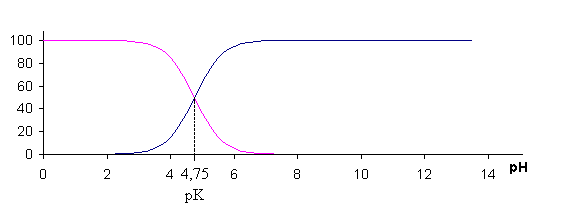
On voit que les deux fonctions
se croisent pour la valeur de pH égale à pKa du couple
acidobasiqueAcOH / AcO- . La valeur de l'ordonnée
à l'intersection est de 50%.
On voit sur le graphe que si le
pH
de la solution est inférieur à pKa-1
alors c'est la forme AcOH qui estmajoritaire: elle représente
de 90 à 100% du total.
En revanche, si le pH
de
la solution est supérieur à pKa + 1, alors
c'est la forme AcO- qui est majoritaire
et qui représente de 90 à 100% du total.
Ce sont les deux intervalles
de pH extrêmes.
Entre les valeurs pKa-1
et pKa +1 , il y a des quantités non
négligeables de l'unedes formes par rapport à l'autre.
A partir de ces considérations sur les proportions respectives des deux formes acidobasiques présentes dans la solution on peut envisager l'application éventuelle des formules approchées.
On se rappelle qu'on avait comme
expression abrégée de la constante d'acidité Ka,
une fois que dans l'électroneutralité on négligeait
les
ions
hydroxyde
de l'eau:
Ka = ![]() .
.
A partir de là on voit que
si
C0est très supérieure à
h,
alors le dénominateur se simplifie et l'on ne retrouve plus
que C0à ce même dénominateur.
Quand est-ce qu'on peut avoir C0
qui est très supérieure à h?
Du fait que h est égal
à (AcO-), c'est lorsqu'on se situe sur le diagramme
de prédominance à gauche de la valeur pKa-1.
A ce moment là on a (AcOH) qui représente au moins 90%
du
total de C0 et on peut considérer, dès
lors, comme négligeable devant C0 la valeur
de (AcO-),
donc celle de h.
On arrive alors à: Ka
= ![]() .
.
A partir de là c'est un
jeu
d'enfant que de prendre le
logarithme décimal de la formule
et que d'arriver à l'expression simple:
pH = 0.5.(pKa-logC0)
C'est "LA" formule "approchée", la "fameuse" formule approchée du pH des monoacides faibles en solution aqueuse.
Quel est son "domaine de validité"?
Il faut pour pouvoir l'appliquer que le pHtrouvé à l'aide de cette formule soit strictement inférieur à la valeur de pKa-1.
Si jamais la valeur trouvée par cette formule est supérieure à la valeur de pKa1 alors il faut résoudre le trinôme, l'équation du second degré en h si vous préférez, obtenu à partir de l'expression de Ka suivante:
Le cas où "ça marche".
Quel est le pH d'une solution aqueuse d'acide éthanoïque de concentration 0.1 mol.L-1 sachant qu'on donne pour valeur de pKa du couple acidobasque AcOH /AcO-la valeur de 4.75 à 25°C?
On applique la formule approchée et on a:
Cette valeur est-elle "plausible"?
Si l'acide avait été "fort" on aurait trouvé pH =1.
Ici il est "faible" donc
c'est "normal" de trouver une valeur plus grande que 1.
La formule approchée
a donné un
pH
qui est strictement inférieur à
3.75, c'est à dire à la valeur numérique de pKa-1,
doncon
pouvait bien l'appliquer.
Le résultat, à défaut
peut-être d'être "juste" est en tout cas plausible
et l'on peut le donner sans "rougir" si j'ose dire.
Le cas où "ça ne marche pas".
Quel est le pH d'une solution aqueuse d'acide éthanoïque, de concentration C0égale à 10-5 mol.L-1, sachant que le pKa vaut, etc.........
On applique la formule approchée.
On pose la calcul suivant:
En conclusion: il ne faut pas oublier "complètement" si l'on veut les formules approchées mais en tout cas mieux vaut s'en méfier. La résolution de l'équation du second degré est, quant à elle, imparable... sauf erreurs de... calcul!
Evoquons, pour conclure ce paragraphe, le cas du pH d'un monoacide faible de concentration C0inférieure à 10-6 mol.L-1.
On voit là aussi que si l'acide
avait été "fort" le pH aurait valu 6 au minimum. Le maximum
étant bien entendu légèrement inférieur à
7.
Ici, comme l'acide est faible on
aura un pH qui sera supérieur à 6 mais inférieur
à la valeur 7.
Si l'on examine le cas de l'acide éthanoïque, on voit sur son diagramme de prédominance que pour l'intervalle de pH compris ente les valeurs 6 et 7 c'est la forme ionisée AcO- qui est largement majoritaire. Comme on est au-delà de la valeur de pKa+1 elle représente même une valeur supérieure à 90%du total de la concentration C0.
Alors, on évoque ce que l'on appelle "l'effet de dilution", ou "l'approximation des acides forts" et l'on voit qu'à très faible concentration (ici le cas limite) un acide faible est complètement ionisé, comme s'il avait été un acide fort.
Si l'on pose la question du pH d'une solution d'acide éthanoïque de concentration C0 égale à 10-7mol.L-1 alors on résoudra la question comme celle de l'acide chlorhydrique (acide fort) à la même concentration (voir plus haut dans mon cours). On tiendra donc compte des ions hydronium et hydroxyde de l'eau et l'on résoudra une équation du second degré en h.
En principe vous ne devez pas rencontrer de difficultés.
Je signale encore que cette question est du genre "académique" et qu'elle n'a, dans la pratique, aucun intérêt réel.
Retour
au plan du cours sur les pH des solutions aqueuses.
II.3.d. Cas d'une monobase faible.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra le cas du gaz ammoniac NH3, mis en solution aqueuse, et dont la solution prend le nom d'"ammoniaque".
On cherchera à calculer le pHd'une solution d'ammoniaque de concentration C0mol.L-1.
L'équation chimique qui a
lieu au sein de la solution est la suivante:
NH3 +H2O ![]() NH4+ + HO-.
NH4+ + HO-.
Le pKa du couple
acidobasque NH4+
/ NH3 est de 9.25
à 25 °C.
Ici, on voit apparaître
un équilibre qui sera plus facilement décrit par la constante
d'équilibre
Kb. En effet dans les produits de
la réaction, à droite de l'équilibre, on trouve l'anion
hydroxyde HO-.
On aura donc Kbqui
sera égal à: ![]()
On écrira l'équation
de conservation de la masse:
Bien entendu on a Ka.Kb
qui est égal à Ke.
A partir de là on résout
une équation du second degré en w, bref,
un trinôme en w.
On arrive donc à l'équation
suivante:
Cette méthode marche tout le temps.
On peut éventuellement
préférer une version qui ne fait intervenir que la constante
Ka et h.
Je donne cette seconde version
pour ceux qui la préfèreraient.
On a Ka qui vaut:![]()
On écrit de nouveau l'équation
de conservation de la masse:
On conclut en éliminant la solution physiquement inacceptable et l'on arrive aisément au pH de la solution.
Bien entendu on doit retrouver, pour C0 donné, le même résultat par la méthode en w et par la méthode en h. Sinon c'est qu'il y a une erreur quelque part.
A vous de choisir dorénavant la méthode qui vous paraît la plus aisée.
On peut également pour trouver
le pH d'une monobase faible en solution aqueuse essayer des formules approchées.
On va essayer de les retrouver.
Il faut tout d'abord tracer le
diagramme
de prédominance des espèces dissoutes pour, par exemple,
le couple NH4+/ NH3 , dont le pKavaut
9.25 à 25°C.
Comme pour le cas de l'acide éthanoïque,
on retrouvera icia, qui sera appelé
"degré de protonation" , relatif à l'évolution
en fonction du pH de la forme protonée NH4+
et 100-a,
relatif à l'évolution
en fonction du pH de la forme non protonée NH3.
On reprend Ka.
Ka
est égal à:![]()
On écrit l'équation
de conservation de la masse:
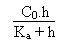 et
(NH3) =
et
(NH3) = 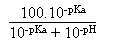
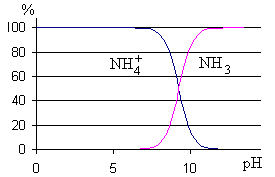
On voit sur le diagramme de prédominance
que dans l'intervalle [pKa-1;pKa+1] les deux
formes coexistent dans des proportions non négligeables l'une par
rapport à l'autre.
Si le pH est inférieur à
pKa-1
alors c'est la forme protonée NH4+ qui
est majoritaire à plus de 90%.
Si par contre le pH du milieu est
supérieur à
pKa+1 alors c'est la forme
non protonée
NH3 qui est majoritaire à
plus de 90%.
C'est cette dernière zone
qui va permettre l'emploi éventuel des formules approchées.
En écrivant l'équation
de conservation de la matière on aura alors:
pH = 7 + 0.5.(pKa + logC0)
Cette formule n'est vraie,
applicable
si vous préférez,
que si le pH cherché
est strictement supérieur àpKa + 1.
A défaut, il faut
calculer le pH à l'aide de l'équation du second
degré, comme précédemment.
A titre d'exercice on calculera,
par
la formule approchée, le pH d'une solution aqueuse d'ammoniaque
de concentration
C0
égale à 0.1
mol.L-1.
On comparera le résultat
à celui trouvé avec l'équation du second degré.
On calculera également le pH d'une même solution, mais à 10-5mol.L-1 cette fois. Conclusion.
Enfin, on terminera avec le cas, encore une fois "académique" du calcul du pH d'une solution de monobase faible de concentration inférieure à 10-6 mol.L-1.
Prenons le cas du calcul du pH d'une
solution d'ammoniaque de concentration égale à 10-8
mol.L-1.
Si la base avait été
forte on aurait eu un pH compris entre 7 et 8: avec une monobase
forte comme l'hydroxyde de sodium on avait trouvé, pour cette même
concentration de
10-8 mol.L-1, un pH
de 7.02.
Ici, comme la monobase est "faible"
on ne peut avoir qu'un pH à la limite plus petit que 7.02.
On remarque, à l'aide du
diagramme de prédominance des espèces dissoutes du couple
NH4+/NH3, que c'est la forme protonée
NH4+ qui est largement majoritaire dans cet intervalle
de pH.
On en conclut qu'à très
faible concentration C0, l'ammoniaque se comporte comme une
monobase forte. On se ramène dès lors aux calculs précédents.
Pour une concentration en ammoniaque
égale à 10-8 mol.L-1 on trouve un pH
de 7.02.
Retour au plan du cours sur les pH des solutions aqueuses.