Retour au plan du cours sur les pH des solutions aqueuses.
IV.1.Cas du dosage d'un acide fort par une base forte.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra l'exemple du dosage d'une solution d'acide
chlorhydrique H3O+ + Cl- de concentration
C0 égale à 0.1mol.L-1, de volume V0
égal à 100 mL, par la soude Na+ + HO-
de concentration Cb égale à 0.5 mol.L-1.
L'équation du dosage est:
La courbe de dosage peut se découper en trois parties distinctes, qui ne présenteront aucune discontinuité.
Première partie: avant l'équivalence.
Deuxième partie: à l'équivalence.
Troisième et dernière partie: après
l'équivalence.
Première partie.
Afin de calculer chaque point de la courbe de dosage
avant l'équivalence il faut faire un bilan de matière initial
sur la solution d'acide chlorhydrique.
Le nombre de moles d'ions hydronium contenu initialement
dans la solution est égal à: C0.V0.
Numériquement cela fait n H3O+
=
0,1.0,1 soit 0.01 mol.
Si l'on ajoute un volume V de soude dans la solution
d'acide chlorhydrique le nombre de moles d'ions hydroxyde apporté
est égal à Cb.V.
Etant donné la réaction entre les ions
hydronium et les ions hydroxyde pour donner de l'eau; étant donné
que V est inférieur à Ve le volume équivalent,
on aura un nombre de moles d'ions hydronium qui restera en solution qui
sera égal à: C0.V0 - CbV
Le volume de la solution étant devenu égal
à V0 + V, la concentration des ions hydronium
restant en solution après ajout d'un volume V de soude sera égale
à:
pH = log(100 + V) - log(10 - 0,5.V)
On pourra s'amuser à calculer le pH de la solution en fonction de V, avant l'équivalence, en faisant par exemple varier V d'un millilitre à chaque fois.
C'est la méthode "traditionnelle".
A l'heure d'Internet il est beaucoup plus intéressant de programmer une telle équation avec Excel. On obtient un listing de valeurs numériques et la courbe.
Deuxième partie de la courbe: l'équivalence.
On se ramène alors au calcul du pH d'une solution
d'acide fort exactement neutralisée par une base forte. On a démontré
au chapitre précédent que le pH à l'équivalence
valait alors 7 à 25°C.
Ici le volume équivalent vaut 20 mL. le pH aura
alors pour valeur 7.
Troisième partie de la courbe: après l'équivalence.
On aura versé depuis le départ un volume
supérieur à 20 mL pour accéder à cette portion
de courbe.
Si l'on appelle V ce volume total de soude versée
(par exemple 25 mL) le nombre total de moles d'ions hydroxyde apportés
est égal à Cb.V.
Comme 1 ion hydroxyde réagit avec 1 ion hydronium
de façon quantitative pour donner de l'eau, la quantité d'ions
hydroxyde en excès sera égale à: Cb.V - C0.V0.
La concentration des ions hydroxyde lorsqu'on aura versé V mL de soude dans la solution d'acide chlorhydrique sera alors égale à:
Dans l'exemple qui est choisi il faudra écrire que :
pH = 14 + log (0.5.V -10) - log(100 + V)
L'ensemble de ces résultats sera listé sur papier et une courbe publiée.
A titre d'exercice on peut s'amuser à calculer le pH en fonction de V pour une solution aqueuse d'acide bromhydrique, de formule H3O+ + Br- , de volume V0 égal à 50 mL, de concentration C0 égale à 0.02 mol.L-1, par l'hydroxyde de potassium K++ HO- de concentration Cb égale à 0.03 mol.L-1.
On s'amusera alors aussi à calculer, en fonction du volume d'agent titrant versé, le pH d'une solution de soude de concentration Cb égale à 0.1 mol.L-1 , de volume V égal à 100 mL, par une solution aqueuse d'acide iodhydrique de formule H3O++ I- de concentration égale à 0.2 mol.L-1.
Il existe bien sûr une "autre" méthode de
calcul de chaque point de la courbe, que l'on soit avant, pendant ou après
l'équivalence.
Cette méthode repose sur la résolution
de l'équation d'électroneutralité.
Retour au plan du cours sur les pH des solutions aqueuses.
IV.2.Cas du dosage d'un acide faible par une base forte.
Retour au plan du cours sur les pH des solutions aqueuses.
On cherchera à calculer le pH d'une solution aqueuse
d'acide éthanoïque CH3CO2H, de concentration
C0 égale à 0.1 mol.L-1, de volume V0
égal à 100 mL, par une solution aqueuse d'hydroxyde de sodium
Na+ + HO-, de concentration Cb égale à 0.5 mol.L-1.
On rappelle que le pKa du couple CH3CO2H/CH3CO2-
est
égal à 4.75 à 25°C et que la constante d'autoprotolyse
de l'eau Ke a pour valeur 10-14 toujours à
25°C.
L'équation du dosage est:
Le calcul des points de la courbe pourra se faire de plusieurs
façons.
La façon la plus "traditionnelle" est d'écrire
l'électroneutralité de la solution et de faire des hypothèses
raisonnables sur le pH de la solution, et ce, que l'on soit avant, pendant
ou après l'équivalence.
On écrira alors:
Afin d'éviter la résolution d'une équation
de degré trois on fait alors des hypothèses raisonnables
sur le pH attendu de la solution.
On postule par exemple qu'avant l'équivalence
le pH sera acide.
A ce moment on raye de l'équation d'électroneutralité
le terme w. On arrive après réarrangement
des termes restants à une équation du second degré.
Cette équation du second degré en h aura
ses termes qui seront fonction du volume V versé de soude. Pour
chaque volume V versé on aura des termes différents et, par
conséquent, une équation du second degré différente
à chaque fois.
L'équation s'écrit littéralement,
sauf erreur de ma part (moi les maths vous savez c'est pas trop mon fort!!!):
A ce moment là la résolution conduit au
pH cherché...
On peut dès lors tracer la courbe avec un listing
de points.
Je vous donne l'exemple du calcul du pH de la solution pour la demi-équivalence, histoire de tester la formule que j'ai établie.
Le volume V correspondant à la demi-équivalence
est V = 10 mL.
La concentration de la soude vaut 0.5 mol.L-1,
celle initiale de l'acide 0.1 mol.L-1. La constante d'acidité
de l'acide éthanoïque vaut 1.78.10-5.
En remplaçant par leurs valeurs numériques
chacun des termes de l'équation du second degré pour un pH
censé être acide on arrive à devoir résoudre:
Yo!!!!
A vous de continuer en prenant par exemple V égal
à 7.5 mL ou V égal à 13 mL, histoire de calculer un
petit peu...
Aujourd'hui il y a une autre méthode.
On travaille avec Excel et on fait résoudre à
la machine l'équation d'électroneutralité complète,
incluant donc h et w, puis on sélectionne
les valeurs physiquement acceptables.
L'équation complète qu'on va fournir à
Excel est la suivante:
(100 + V).h3 + [0.5.V + 1.78.10-3].h2 + (8.9.10-6.V - 1.78.10-4).h -1.78.10-19.(100 + V) = 0
A ce moment là, sachant que les solutions physiquement
acceptables sont comprises entre 10-14 et 1, bref pour des pH
compris entre 0 et 14, le logiciel calcule chaque valeur de pH après
avoir calculé chacun des termes du polynôme et résolu
l'équation du troisième degré.
C'est bien à cela que servent les machines, à
faire des travaux très pénibles...
Retour au plan du cours sur les pH des solutions aqueuses.
IV.3.Cas du dosage d'une base faible par un acide fort.
Retour au cours sur les pH des solutions aqueuses.
On cherchera à calculer les valeurs des pH de la courbe de neutralisation d'une monobase faible, l'ammoniac NH3, de concentration Cb égale à 0.1 mol.L-1, de volume Vb égal à 100 mL , par l'acide chlorhydrique H3O+ + Cl-, de concentration Ca égale à 0.5 mol.L-1.On versera à chaque fois un volume V d'acide chlorhydrique dans la solution ammoniacale.
L'équation de l'électroneutralité est la suivante:

Commençons par la méthode traditionnelle.
On fait des hypothèses raisonnables sur la valeur
attendue du pH et on raye dans l'équation de l'électroneutralité
soit h devant w, soit w
devant h.
Si jamais en rayant, par exemple, h devant
w on résout l'équation de l'électroneutralité
et qu'on aboutit à un pH acide alors il faut reprendre l'équation
de l'électroneutralité, rayer w devant
h et puis résoudre. la méthode artisanale est faite de tâtonnements,
d'erreurs mais on arrive toujours à retomber sur ses pieds.
Si l'on postule que le pH est basique on a à résoudre l'équation suivante, sachant que Ke est égal à h.w:
Je vous conseille vivement de très vite remplacer les expressions littérales par des valeurs numériques. L'équation du second degré vous paraîtra alors pour ce qu'elle est, à savoir une équation toute bête.
Si jamais le pH n'est pas basique mais au contraire acide, alors il faut reprendre l'équation d'électroneutralité, rayer w devant h et on arrive alors à une équation du second degré qui a l'allure suivante:
Je donne l'exemple du calcul du pH de la solution lorsque
le volume d'acide chlorhydrique versé est égal à 10
mL, bref lorsqu'on est à la demi-équivalence, donc un pH
attendu de 9.25:
Vu que Ca = 0.5 mol.L-1, que Cb = 0.1 mol.L-1,
que Vb = 100 mL et que V = 10 mL, en remplaçant dans l'équation
censée donner un pH basique on arrive à l'équation
du second degré suivante:
Si au contraire on prend la méthode complète avec Excel on arrive à l'équation de degré trois suivante:
On exprimera V et Vb en mL , Ca et Cb en mol.L-1.
L'équation s'écrira dans l'exemple qui
est choisi, en tenant compte des ordres de grandeur respectifs des termes
les uns vis à vis des autres:
(100+V).h3 +(0.5.V - 10).h2 + 2.81.10-9.V.h + 5.6.10-24.(100 +V) = 0
Excel fournira un listing de valeurs et la courbe.
A vous de jouer maintenant.
Retour
au plan du cours sur les pH des solutions aqueuses.
IV.4. Calcul de la courbe de dosage d'un acide faible par une base faible.
Retour au plan du cours sur les pH des solutions aqueuses.
On cherchera à calculer les valeurs de pH des différents points de la courbe de neutralisation de l'acide éthanoïque, de concentration C0 égale à 0.1 mol.L-1, par l'ammoniaque de concentration égale à 0.5 mol.L-1. Le volume initial de la solution d'acide éthanoïque sera pris égal à 100 mL et l'on rappelle que les pKa respectifs de l'acide éthanoïque et de l'ion ammonium sont, dans l'eau, à 25°C, égaux à 4.75 et 9.25.
L'équation chimique du dosage est la suivante:
La résolution complète du problème
passe par la résolution de l'équation de l'électroneutralité.
On aura alors:
J'en donne les grandes lignes ci-dessous.
A l'instant initial il faudra juste calculer le pH d'une solution d'un monoacide faible de concentration et de pKa connus.
Au cours du dosage, avant l'équivalence, on aura
la possibilité d'utiliser la constante d'acidité Ka de l'acide
éthanoïque, notamment sous sa forme logarithmique, afin de
calculer le pH.
On aura alors:

Quand est-ce que cette formule est mise en défaut?
C'est lorsqu'on part d'une valeur de pH qui est supérieure
au pKa du couple acide éthanoïque/ion éthanoate. C'est
le cas lorsque la concentration en acide éthanoïque au départ
est faible et que l'hydrolyse de la molécule d'acide conduit à
une quantité non négligeable d'anion éthanoate dès
le départ.
Cela se retrouve aussi lorsqu'au lieu de prendre l'acide
éthanoïque on prend un acide plus fort et qu'on surajoute une
autre "difficulté" , je veux parler d'une faible concentration en
acide au départ.
A ce moment là le mieux à mon avis est
de résoudre l'équation d'électroneutralité
de la solution:
A l'équivalence on se retrouve avec le calcul du pH d'un sel de base faible et d'acide faible. On essaiera la formule magique:
Après l'équivalence on se retrouvera avec un mélange dans des proportions conséquentes d'ammoniac NH3 et d'ion ammonium. On calculera le pH de la solution en utilisant la formule:
Pour les "mordus" de ces dosages d'acide faible par une
base faible je poserai comme question ultra "vache" le calcul des pH de
la courbe de dosage de 100 mL d'une solution aqueuse d'acide oxalique (diacide
faible), de concentration égale à 0.1 mol.L-1
par l'ammoniaque de concentration 0.5 mol.L-1.
Amusez-vous bien!!!!!!!
Pour vous aider je vous donne l'équation d'électroneutralité
qu'il faudrait résoudre alors:
Mais la chimie est elle un jeu mathématique? Ne se trompe t-on point de sphère?
Je vous souhaite bien du "plaisir" et vous encourage alors, plutôt que de perdre du temps, à faire la manip directement.C'est un excellent exercice expérimental, incontournable, mais j'espère surtout que personne n'aura l'idée saugrenue de poser à des étudiants de première année une question aussi difficile. Il y a tant de choses intéressantes à découvrir de par la chimie autres que cet exercice de pH. Voyage à Chimiland....
Retour au plan du cours sur les pH des solutions aqueuses.
IV.5. Dosage d'un polyacide faible par une monobase forte.
Retour au plan du cours sur les pH des solutions aqueuses.
IV.5.a. Conditions sur les valeurs consécutives de deux pKa d'un polyacide faible pour doser séparément deux acidités.
Retour au plan du cours sur les pH des solutions aqueuses.
Soit un diacide H2A. Il possède deux
constantes d'acidité successives, caractérisées par
leurs pKa respectifs, pKa1 et pKa2.
Si l'on dose cet acide par une base forte quelle est
la condition que doivent remplir les deux pKa pour qu'on puisse avoir,
par exemple, lors du dosage de la première acidité, 98% du
total qui soit sous la forme HA-, avec seulement 1% de forme
H2A et juste 1% de forme A2-?
Il faut écrire l'expression littérale de
chacune des constantes Ka1 et Ka2, en fonction de
h et des concentrations des espèces dissoutes H2A, HA-
et A2-.Ces expressions restent vraies quel que soit le pH de
la solution et, par conséquent, sa composition en espèces
dissoutes.
On fait le rapport de Ka1 sur Ka2
et on arrive à:

IV.5.b.a. Dosage d'un diacide faible, l'acide sulfureux, ou dioxyde de soufre en solution aqueuse.Cas où la différence de pKa est supérieure à 4.
Retour au plan du cours sur les pH des solutions aqueuses.
Le dioxyde de soufre en solution aqueuse SO2 aq
, ou SO2,H2O,ou H2SO3,
est susceptible de donner deux équilibres acidobasiques, caractérisés
par deux constantes d'acidité Ka1 et Ka2 respectivement.
Nous aurons donc:
Nous chercherons à calculer les points de la courbe
de dosage d'une solution aqueuse de dioxyde de soufre de concentration
C0 égale à 0.1 mol.L-1 et de volume
V0 égal à 100 mL, par une base forte, l'hydroxyde
de sodium de concentration Cb égale à 0.5 mol.L-1.
La première des choses à faire est, à
mon avis, de calculer les différents volumes équivalents,
afin de mieux centrer la courbe.
Calcul du premier volume équivalent, noté
Ve.
La réaction du dosage est:
Pour étudier cette courbe je pense que le mieux est de la découper en trois morceaux.
Première partie: de V = 0 mL à V = 20 mL
ou, si l'on préfère, de V/Ve égal à 0 à
V/Ve égal à 1.
On commence par calculer les deux pH extrêmes.
La courbe de pH étant forcément strictement
croissante toutes les valeurs de pH seront forcément comprises entre
les deux valeurs extrêmes précédentes.
Premier calcul: calcul du pH d'une solution aqueuse de
dioxyde de soufre, de concentration égale à 0.1 mol.L-1.
Vu ce qui a été vu précédemment
lors du calcul des pH des solutions de diacides on pourra considérer
que le dioxyde de soufre SO2 en solution aqueuse se comporte
en fait comme un monoacide faible de pKa égal à pKa1,
soit la valeur 2.0, à 25°C.
On appliquera la résolution de l'équation
du second degré suivante:
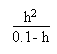
Ainsi donc entre V = 0 mL et V = 20 mL le pH de la solution
variera entre 1.57 et 4.80.
Si l'on trace le diagramme de prédominance des
espèces dissoutes du dioxyde de soufre en fonction du pH on voit
que le dioxyde de soufre se comporte comme un monoacide faible de pKa égal
à pKa1 et que la forme sulfite SO32-
est négligeable dans tous les calculs.
On peut également se rappeler que la constante
Kr de la réaction de dosage

A titre d'exemple on calculera numériquement la
valeur du pH lorsque le volume de soude versée est de 10 mL, bref
lorsqu'on est à V/Ve qui est égal à 0.5.
L'équation du second degré à résoudre
est la suivante, compte tenu des diverses valeurs numériques:
Si je devais préférer une méthode je pencherais sans hésiter pour la résolution de l'équation d'électroneutralité dans tous les cas, plutôt que de me noyer dans certaines autres considérations qui ne sont pas applicables en toutes circonstances hélas.
Deuxième partie de la courbe maintenant: entre V = 20 mL et V = 40 mL de soude versée, soit entre V/Ve = 1 et V/Ve = 2.
L'équation du dosage devient alors:
On part d'un pH de 4.80 à V= 20 mL (soit V/Ve =1)
pour arriver au pH d'une solution aqueuse de sulfite de sodium Na2SO3
de concentration égale à 0.071 mol.L-1, compte
tenu des 40 mL de soude versés dans les 100 mL initiaux de solution.
Le facteur de dilution n'est pas négligeable.
Le sulfite de sodium a un comportement qui s'identifie
à celui d'une monobase faible dont le pKb est égal à
pKb2, soit numériquement ici 6.4.On a déjà
vu cela lors du calcul du pH des polybases faibles.
On essaiera d'appliquer la formule magique du pH des
monobases faibles et assimilées:
On va chercher à savoir si la réaction d'amphotérisation
de l'anion hydrogénosulfite est susceptible de modifier les concentrations
en espèces dissoutes, par rapport aux concentrations des anions
hydrogénosulfite et sulfite.
La réaction d'amphotérisation est la suivante:
J'en conviens ce sont là des "subtilités"
assez "subtiles" et j'en reviens encore une fois à plaider, malgré
sa "lourdeur", pour la résolution de l'équation de
l'électroneutralité qui, elle, marche toujours...
Le seul problème c'est qu'alors ça devient
peut-être beaucoup trop calculatoire....
Rien n'est parfait en ce bas monde hélas....
On pourra bien entendu comparer les résultats obtenus
avec cette méthode "simplifiée" et ceux fournis par LA référence,
à savoir l'équation d'électroneutralité.
Je vous en donne la forme:
Si l'on choisit de résoudre l'équation de l'électroneutralité, qui marche toujours je le répète encore, il faut alors résoudre:
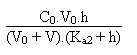 +
+ 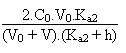
Prenons pour exemple le pH attendu lorsque V = 30 mL,
bref lorsque V/Ve est égal à 1.5.
Le pH attendu est supposé être égal
à 7.6, bref à la valeur pH = pKa2.
L'équation de l'électroneutralité
simplifiée en fonction de cette hypothèse de pH basique devient,
réarrangée en équation du second degré:
On peut arriver à des résultats comparables
en utilisant la relation de HENDERSON.
A ce moment là il faut juste exprimer (HSO3-)
et (SO32-) en fonction des données.
On arrive alors à:
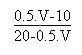
Troisième et dernière partie de la courbe
de dosage: après la seconde et dernière équivalence,
après V = 40 mL, soit après V/Ve =2.
On se retrouve alors avec un excès de soude dans
le milieu . La valeur asymptotique du pH tendra vers le pH de la soude
de concentration égale à 0.5 mol.L-1 pour
un volume V de soude versé infini.
Avant d'atteindre cette asymptote les valeurs seront
comprises entre pH = 10.26 et pH = 14 + log0.5, soit 13.70,
du moins en théorie. En effet les électrodes de pH donnent
ce qu'on appelle "l'erreur alcaline" pour des pH par trop basiques, supérieurs
à 12. On verra cela dans un paragraphe ultérieur consacré
aux électrodes.
La concentration des ions hydroxyde au delà de
V = 40 mL, soit de V/Ve = 2, sera donnée par la relation:
| Volume V de soude versée (en mL) | V/Ve | pH |
| 0 | 0 | 157 |
| 10 | 0.5 | 2.14 |
| 20 | 1.0 | 4.80 |
| 30 | 1.5 | 7.60 |
| 40 | 2.0 | 10.23 |
| 60 | 3.0 | 12.80 |
| infini | infini | 13.70 (attention erreur alcaline) |