HT- + H2O
IV.5.b.b. Dosage de l'acide tartrique. Cas où D pKa est inférieur à 4.
Retour au plan du cours sur les pH des solutions aqueuses.
L'acide tartrique HO2C-CHOH-CHOH-CO2H,
noté "H2T" , est le principal acide du vin auquel il
impose un pH compris entre 3.5 et 4.0.
Il est susceptible de donner deux équilibres acidobsiques
caractérisés respectivement par deux constantes d'acidité
Ka1 et Ka2, donc par conséquent, deux pKa,
pKa1 et pKa2, ayant pour valeurs 3.13 et 4.31.
Par commodité dactylographique on notera l'anion
hydrogénotartrate HO2C-CHOH-CHOH-CO2-
par "HT-" et l'anion tartrate -O2C-CHOH-CHOH-CO2-
par
"T2-".
Les deux équilibres acidobasiques seront donc:
Première partie.
On commencera par calculer le pH initial de la solution.
On s'inspirera de ce qui a été fait pour
calculer le pH d'une solution aqueuse d'un polyacide faible.
Pour une concentration d'acide tartrique égale
à 0.1 mol.L-1 on a montré que l'acide tartrique
adoptait un comportement de monoacide faible de pKa égal à
pKa1. la seconde acidité étant négligeable
devant la première. Je vous renvoie à cette partie précédente
du cours "on line".
On a trouvé que le pH initial de la solution était de 2.08.
On calculera ensuite le pH de la solution lorsque V = Ve mL de soude versée, soit 20 mL ici.
L'équation du dosage est la suivante:
On pourra vérifier que l'anion hydrogénotartrate ne subit pas d'hydrolyse en anion tartrate et ion hydronium, ou plutôt que cette hydrolyse, caractérisée par la constante d'équilibre Ka2, est négligeable devant la réaction d'amphotérisation. Cette vérification a été faite dans la partie sur les hydrogénosels que j'ai traitée plus haut.Il faut faire un tableau avec les valeurs des concentrations des espèces dissoutes "avant" et "après" puis résoudre en fin de compte une équation du second degré.
Le pH imposé alors par la réaction d'amphotérisation est bien égal à 3.72, ce que donnait la formule magique.
Que vaut le pH de la solution pour un volume de soude
versé égal par exemple à 10 mL?
L'équation complète de l'électroneutralité
de la solution s'écrit:
On cherchera donc, dans un premier temps, à résoudre l'équation suivante:

On fera un tableau afin de préciser les concentrations
des diverses espèces dissoutes "avant" et "après" l'instauration
de tous les équilibres possibles, censés s'instaurer dans
le milieu.
Les données sont fournies en mol de substance
dissoute par litre de solution.
| HT- | H2T | T2- | |
| Avant instauration de l'équilibre d'amphotérisation. | 0.042 | 0.042 | 0 |
| Après instauration de l'équilibre d'amphotérisation | 0.042 - 2.x | 0.042 + x | x |
Il faut alors résoudre l'équation du second degré obtenue d'après:
| (H2T) | 4.41.10-2 mol.L-1 |
| (HT-) | 3.78.10-2 mol.L-1 |
| (T2-) | 2.12.10-3 mol.L-1 |
On vérifie que la somme des trois concentrations
est bien égale à 0.083 mol.L-1, aux erreurs d'arrondi
près.
En appliquant désormais les expressions des constantes
d'acidité, soit Ka1 soit Ka2 au choix, on
arrive à trouver h, donc le pH, connaissant Ka1, ou Ka2,
(H2T), (HT-) et (T2-).
A vec Ka1 on arive à pH = 3.06.
Avec la méthode simplifiée on avait trouvé
pH = 3.14.
Comme les calculs de pH ne tolèrent qu'une erreur
de 0.05 entre deux méthodes distinctes on considèrera
qu'on était en droit d'appliquer une méthode plus complète
afin de trouver le pH à V = 10 mL, soit à V/Ve = 0.5.
Cette méthode sera à appliquer pour tous
les points compris entre V = 0 mL et V = 20 mL.
Elle sera plus ou moins "utile" cela dépendra
des valeurs de V.
Deuxième partie de la courbe: entre V = 20 et V
= 40 mL, soit entre V/Ve = 1 et V/Ve = 2.
La réaction du dosage est alors:
On calculera la valeur extrême du pH lorsque
V = 40 mL, soit lorsque V/Ve = 2.
On se retrouve avec une solution de tartrate de sodium
Na2T de concentration égale à 0.071 mol.L-1
en raison du facteur de dilution introduit par les 40 mL de soude versés
dans les 100 mL de solution.
On appliquera la formule magique suivante:
Que vaut le pH de la solution lorsqu'on a versé
un volume V de soude égal à 30 mL par exemple?
On est alors à V/Ve = 1.5.
Dans un premier temps on calculera les concentrations
en HT- et T2- à l'aide de la réaction:
| HT- | H2T | T2- | |
| Avant instauration de l'équilibre d'amphotérisation | 0.0385 | 0 | 0.0385 |
| Après instauration de l'équilibre d'amphotérisation | 0.0385-2.x | x | 0.0385 +x |
| H2T | 1.95.10-3 |
| HT- | 4.045.10-2 |
| T2- | 3.46.10-2 |
On vérifie, aux erreurs d'arrondi près,
que la somme des trois concentrations fait bien 0.077 mol.L-1,
concentration lorsque V = 30 mL de soude versée dans les 100 mL
de solution d'acide tartrique.
On peut dès lors, à l'aide des constantes
d'acidité Ka1 ou Ka2, remonter à la
valeur du pH de la solution à v = 30 mL.
On trouve que le pH vaut 4.24.
On recommencera ainsi pour toutes les valeurs comprises entre V/Ve = 1 et V/Ve = 2.
Troisième partie de la courbe: après V =
40 mL, soit après V/Ve = 2.
On est alors en présence d'un excès de
soude. C'est cet excès qui imposera le pH de la solution.
On calculera le pH de la solution lorsque le volume V
de soude versé est égal à 50 mL, bref lorsqu'on se
situe à V/Ve = 2.5.
Le pH de la solution sera donné, tout comme pour
le cas du dioxyde de soufre en solution aqueuse (exemple précédent),
par la formule:
| Volume V de soude versée (en mL) | V/Ve | pH |
| 0 | 0 | 2.08 |
| 10 | 0.5 | 3.06 (et non 3.13) |
| 20 | 1.0 | 3.72 |
| 30 | 1.5 | 4.24 (et non 4.31) |
| 40 | 2.0 | 8.58 |
| 50 | 2.5 | 12.52 |
| infini | infini | 13.70 (attention erreur alcaline) |
Retour au plan du cours sur les pH des solutions aqueuses.
IV.5.b.g. Cas du dosage d'un diacide idéal.
Retour au plan du cours sur les pH des solutions aqueuses.
Les deux exemples précédents illustrent
bien le fait qu' hormis la résolution de l'équation
de l'électroneutralité sous sa forme complète il n'y
a guère de méthode simple, ou plutôt généralisable
à l'infini, pour calculer tous les points d'une courbe de dosage.
Tantôt la relation d'HENDERSON s'applique, tantôt
elle ne s'applique pas.
Tantôt on a pH = pKa à la demi-équivalence,
tantôt on ne l'a pas. Etc....
Tout cela dépend en fait de deux facteurs: la
valeur de la concentration initiale de l'acide et les valeurs respectives
des deux pKa de l'acide.
Je vous donne, à titre d'exemple, ou plutôt
à titre de conte de fée, le cas d'un diacide idéal
qui aurait le mérite de donner des calculs simples pour chaque partie
de sa courbe de dosage.
La courbe est toujours découpée en trois
parties.
Première partie: entre V/Ve = 0 et V/Ve = 1.
Pour V = 0 le pH idéal est calculé
à l'aide de la formule magique:
Deuxième partie: entre V/Ve = 1 et V/Ve = 2.
Pour V/Ve = 1.5 le pH est égal à pKa2.
Pour V/Ve = 2 le pH est donné par la formule magique:
Troisième partie: au-delà de V/Ve = 2.
Le pH est donné par la formule:
Je ne saurais trop vous recommander, dans la mesure du
possible, de toujours faire les manips vous mêmes avant de vous lancer
dans des calculs qui peuvent sembler par trop délirants.
L'expérience c'est ça qui est déterminant.
La chimie n'étant pas une science exacte mais
expérimentale il faut toujours se raccrocher à l'expérience.
Les modélisations par trop mathématiques
ça ne marche pas toujours.
On peut le regretter mais c'est ainsi.
Ces exercices n'ont pour d'autre but que de vous "amuser"
(!!!!) et ne sont pas faits pour vous dégoûter à jamais
des pH. Loin de là!
Un de mes meilleurs profs de chimie, un certain JPB de
l' université de Bordeaux I , disait toujours: "Les
pbs de pH ça n'existe pas. Il faut juste tremper l'électrode
et on lit."
Il avait bien raison Jean-Pierre, oui, il avait bien
raison....
IV.5.b.d.Dosage d'un triacide faible, l'acide phosphorique. Cas où D pKa est supérieur à 4.
Retour au plan du cours sur les pH des solutions aqueuses.
On cherchera à calculer le pH des différents points de la courbe de dosage de 100 mL d'une solution aqueuse d'acide phosphorique, triacide faible minéral de formule H3PO4, de concentration C0 égale à 0.1 mol.L-1 par une solution aqueuse d'hydroxyde de sodium de concentration égale à 0.5 mol.L-1.Les valeurs respectives des trois pKa de l'acide phosphorique valant à 25°C 2.15, 7.20 et 12.10.
Comme d'habitude, désormais, on commencera
par scinder la future courbe de dosage en quatre parties:
Première partie: de V/Ve = 0 à V/Ve = 1.
Deuxième partie: de V/Ve = 1 à V/Ve = 2.
Troisième partie: de V/Ve = 2 à V/Ve =
3.
Quatrième et dernière partie: au-delà
de V/Ve = 3.
Dans l'exemple qui est choisi on aura Ve qui sera égal à 20 mL. C'est le volume de soude qu'il faut verser dans les 100 mL de solution initiale pour obtenir la première équivalence acidobasique, celle qui donne le premier des hydrogénosels de l'acide phosphorique le dihydrogénophosphate de sodium, de formule NaH2PO4.Sa concentration sera alors égale, compte tenu du facteur de dilution, à 0.083 mol.L-1.
La seconde équivalence, pour V = 40 mL correspondra à la formation du deuxième hydrogénosel de l'acide phosphorique le monohydrogénophosphate de disodium, plus communément appelé hydrogénophosphate de sodium, de formule Na2HPO4, de concentration égale à 0.071 mol.L-1, en raison du facteur de dilution.
La troisième équivalence, pour V = 60 mL correspondra à la formation de phosphate de trisodium, plus communément appelé phosphate de sodium, de formule Na3PO4 et de concentration, compte tenu du facteur de dilution, égale à 0.0625 mol.L-1.
Au-delà de la troisième équivalence on aura un excès de soude en présence de phosphate de sodium.
Première partie: entre V = 0 et V = Ve = 20 mL,
soit entre V/Ve = 0 et V/Ve = 1.
Le pH initial sera celui d'une solution d'un polyacide
faible qui se comportera en fait comme un monoacide faible de pKa égal
à pKa1.
On ne pourra pas appliquer la formule magique suivante:
Calculons le pH lorsqu'on est à V = 20 mL.
On a atteint alors la première équivalence.
On a une solution de dihydrogénophosphate de sodium
NaH2PO4 de concentration égale à
0.083 mol.L-1.Comme c'est un hydrogénosel on cherchera
à appliquer tout d'abord la formule magique suivante:
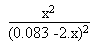
On regarde maintenant si la réaction d'hydrolyse
de l'anion dihydrogénophosphate en hydrogénophosphate est
de nature à modifier le pH fourni par la formule magique des hydrogénosels.
La réaction est la suivante:
| H2PO4- | H3O+ | HPO42- | |
| Avant instauration de l'équilibre d'hydrolyse acide de l'anion dihydrogénophosphate | 0.0825 =
0.083 -2.2,48.10-4 |
0 | 2.48.10-4 |
| Après instauration de l'équilibre acidobasique | 0.0825 - x | x | 2.48.10-4 + x |
Que vaut le pH de la solution lorsque V= 10 mL, bref lorsqu'on est à V/Ve = 0.5?
Il y a tout lieu de s'attendre à une valeur de pH qui sera proche de pKa1, voire égale à pKa1. L'équation complète de l'électroneutralité de la solution, à savoir:
La réaction prépondérante secondaire est l'action des ions hydroxyde sur la molécule d'acide phosphorique, conduisant à l'anion dihydrogénophosphate.
On aura à résoudre une équation du
second degré obtenue après avoir donné leur expression
numérique à chacun des termes de l'expression littérale
de l'électroneutralité.
On a:

Si l'on veut généraliser ce mode de calcul on est amené à devoir résoudre l'équation du second degré suivante pour toute valeur de V comprise ente V = 0 et V = 20 mL.
Deuxième partie: calcul du pH des points de la courbe entre V/Ve = 1 et V/Ve = 2.
Lorsque V/Ve = 1 on a un pH de 4.68.
Lorsque V/Ve = 2 on est en présence d'une solution aqueuse d' hydrogénophosphate de disodium Na2HPO4 , de concentration égale à 0.071 mol.L-1.
La réaction prépondérante est la réaction entre les ions hydroxyde apportés par la soude et les ions dihydrogénophosphate:
On reprend la même méthode que pour le premier des hydrogénosels de l'acide phosphorique, à savoir le dihydrogénophosphate de sodium NaH2PO4 et l'on constate qu'on arrive à un pH de 9.65. C'est la valeur trouvée également en appliquant la formule magique des hydrogénosels. On en déduit que l'hydrogénophosphate de disodium Na2HPO4 est un pur hydrogénosel et qu'il ne conduit pas à une hydrolyse partielle susceptible de modifier la valeur du pH de la solution.
On constate encore une fois que le pH de l'hydrogénosel à cette concentration est indépendant de sa concentration.
Entre V/Ve = 1 et V/Ve = 2, bref pour des volumes de soude versés compris entre 20 et 40 mL, le pH de la solution étudiée variera de 4.68 à 9.65.
Que vaut le pH de la solution lorsque V/Ve = 1.5, bref lorsqu'on a versé 30 mL de soude dans 100 mL de solution d'acide phosphorique?
Il faut revenir à l'électroneutralité
de la solution.
Vu que le pH sera de toute façon inférieur
à 9.65 on peut, d'ores et déjà, négliger le
terme en phosphate dans l'équation d'électroneutralité.
Celle ci s'écrira dès lors:
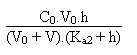
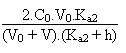
Troisième partie: entre V/Ve = 2 et V/Ve = 3.
Lorsque V/Ve = 3 on se retrouve avec une solution aqueuse
de phosphate de trisodium Na3PO4, plus communément
appelé phosphate de sodium, de concentration égale à
0.0625 mol.L-1.
Le pH de la solution sera donné en faisant intervenir
la constante Kb3 de l'acide phosphorique.Sa valeur numérique
est égale, à 25°C, à 1.26.10-2.Le phosphate
de sodium, tribase faible, se comporte en fait comme une monobase faible
de pKb égal à pKb2, soit numériquement
1.90.L'équation de second degré en wqu'on
obtient est alors la suivante:
Si l'on veut calculer le pH de la solution en un point quelconque de la courbe compris dans cet intervalle il faudra résoudre l'équation d'électroneutralité qui aura la forme suivante:
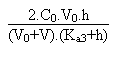 +
+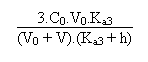
Si l'on avait choisi un volume de soude versée V quelconque, mais compris entre 40 et 60 mL, on aurait eu à résoudre l'équation du second degré suivante:
Quatrième et dernière partie: au-delà de V/Ve = 3.
Que vaut le pH de la solution lorsque le volume V de soude versée est de 70 mL?
On est alors en présence d'un excès de soude
et de phosphate de trisodium. C'est l'excès de soude, base forte,
qui imposera le pH de la solution.
Le pH de la solution sera donné par la formule:
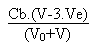
| Volume V de soude versée (mL) | V/Ve | pH |
| 0 | 0 | 1.67 |
| 10 | 0.5 | 2.25 (et non pas 2.15, valeur de pKa1) |
| 20 | 1.0 | 4.68 |
| 30 | 1.5 | 7.20 (pKa2) |
| 40 | 2.0 | 9.65 |
| 50 | 2.5 | 11.90 (et non pas 12.10, pKa3) |
| 60 | 3.0 | 12.35 |
| 70 | 3.5 | 12.47 |
| infini | infini | 13.70(attention erreur alcaline) |