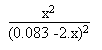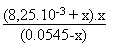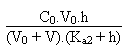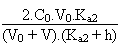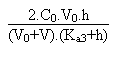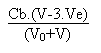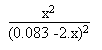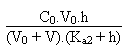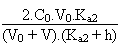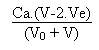IV.5.b.e.
Dosage de l'acide citrique, H3Ci, par la soude. Cas où
D
pKa est inférieur à 4.
Retour
au plan du cours sur les pH des solutions aqueuses.
L'acide citrique, de formule brute C6H8O7
, abrégé par commodité dactylographique en H3Ci,
est un triacide organique dont les pKa respectifs sont de 3.10, 4.76 et
6.40.
On se propose de calculer les valeurs des pH des points
de la courbe de dosage d'une solution aqueuse d'acide citrique de volume
V0 égal à 100 mL et de concentration C0
égale à 0.1 mol.L-1, par une solution aqueuse
d'hydroxyde de sodium de concentration Cb égale à 0.5
mol.L-1.
Le volume de soude Ve nécessaire pour obtenir
la première équivalence sera égal à 20 mL.
On aura alors une solution de dihydrogénocitrate
de sodium, de formule abrégée NaH2Ci, de concentration
égale à 0.083 mol.L-1, compte tenu du facteur
de dilution introduit par l'ajout de 20 mL de soude dans 100 mL de solution.
Lorsque le volume V de soude est égal à
40 mL on se retrouve avec une solution aqueuse d' hydrogénocitrate
de disodium, plus communément appelé hydrogénocitrate
de sodium, de formule abrégée Na2HCi, de concentration
égale à 0.071 mol.L-1.
Lorsque le volume V de soude versée est égal
à 60 mL on se retrouve avec une solution aqueuse de citrate de trisodium,
plus communément appelé citrate de sodium, de formule abrégée
Na3Ci, de concentration égale à 0.062 mol.L-1.
Au-delà d'un volume V de soude versée égal
à 60 mL on se retrouve avec un mélange de soude et de citrate
de sodium.
La courbe de dosage se découpera en quatre
zones.
Première partie: entre V/Ve = 0 et V/Ve = 1.
On calculera le pH initial de la solution d'acide citrique
à 0.1 mol.L-1.
L'acide citrique se comportera comme un monoacide faible
de pKa égal à pKa1.
On aura alors:
Ka1 =  On aura alors à résoudre l'équation
du second degré suivante:
h2 + 7.94.10-4.h -7.94.10-5
= 0
La solution conduit à un pH de 2.07.
On aura alors à résoudre l'équation
du second degré suivante:
h2 + 7.94.10-4.h -7.94.10-5
= 0
La solution conduit à un pH de 2.07.
Le degré de dissociation a
de l'acide citrique à la concentration de 0.1 mol.L-1
est de 8.51%.
On pourra montrer aisément que la seconde acidité
est négligeable devant la première en reprenant les divers
exemples que j'ai traités dans mon cours.
Si l'on veut calculer le pH de la solution d'acide citrique
entre V/Ve = 0 et V/Ve = 1 il faudra résoudre l'équation
de l'électroneutralité en maintenant les ions hydronium dans
l'équation. On ne pourra pas faire l'approximation de HENDERSON,
du moins au départ.
On résoudra alors:
h + (Na+) = (H2Ci-)
La réaction prépondérante sera alors
la réaction entre les ions hydronium provenant de la dissociation
non négligeable de l'acide citrique et les ions hydroxyde provenant
de la soude.
La réaction prépondérante secondaire
sera la suivante:
H3Ci + HO-  H2Ci-
+ H2O
La constante de réaction Kr sera alors
égale au rapport de Ka1 sur Ke, soit, numériquement
à 25°C 7.94.1010. Si l'aspect cinétique va
dans le même sens que l'aspect thermodynamique alors la réaction
sera quantitative de la gauche vers la droite. C'est d'ailleurs ce qu'on
observe expérimentalement.
H2Ci-
+ H2O
La constante de réaction Kr sera alors
égale au rapport de Ka1 sur Ke, soit, numériquement
à 25°C 7.94.1010. Si l'aspect cinétique va
dans le même sens que l'aspect thermodynamique alors la réaction
sera quantitative de la gauche vers la droite. C'est d'ailleurs ce qu'on
observe expérimentalement.
Calculons le pH de la solution lorsque le volumeV de
soude versée est égal à 10 mL, bref lorsqu'on
est à V/Ve = 0.5.
On tiendra compte, bien évidemment des facteurs
de dilution dans l'expression de chacune des concentrations.
On aura, comme d' habitude:
(Na+) = 
et: (H2Ci-) =  Numériquement on sera amené à résoudre
une équation du second degré:
110.h2 +5.0374.h -4.10-3 =
0
On arrive à un pH de 3.11, soit la valeur de pKa1.
Numériquement on sera amené à résoudre
une équation du second degré:
110.h2 +5.0374.h -4.10-3 =
0
On arrive à un pH de 3.11, soit la valeur de pKa1.
Que vaut le pH de la solution lorsque le volume de souve
versée V est égal à Ve, soit 20 mL, bref lorsqu'on
est à V/Ve = 1?
On appliquera dans un premier temps la formule magique
des hydrogénosels:
pH = 0,5.(pKa1 + pKa2)
On arrivera numériquement à une valeur de pH
égale à 3.93 à 25°C.
On pourra lors vérifier la validité, ou
la non validité de la formule magique.
Cette valeur de pH est calculée en tenant compte
uniquement de la réaction d'amphotérisation de l'anion dihydrogénocitrate
en hydrogénocitrate et acide citrique, soit:
2H2Ci-  H3Ci
+ HCi2-
La constante d'équilibre de cette réaction
d'amphotérisation est égale au rapport des constantes d'acidité
Ka2 sur Ka1. Numériquement, à 25°C,
on trouve: 0.022.
H3Ci
+ HCi2-
La constante d'équilibre de cette réaction
d'amphotérisation est égale au rapport des constantes d'acidité
Ka2 sur Ka1. Numériquement, à 25°C,
on trouve: 0.022.
Il faut alors vérifier si l'anion dihydrogénocitrate
H2Ci- est susceptible, ou non, de donner une
réaction d'hydrolyse partielle, acide ou basique, qui serait de
nature à modifier la valeur du pH obtenu grâce à la
formule magique des hydrogénosels.
On sera amené à résoudre l'équation
suivante:
0.022 = 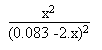 On se retrouve avec les concentrations suivantes, exprimées
en mol.L-1, pour les diverses espèces dissoutes:
On se retrouve avec les concentrations suivantes, exprimées
en mol.L-1, pour les diverses espèces dissoutes:
| H2Ci- |
0.064 |
| HCi2- |
9.47.10-3 |
| H3Ci |
9.47.10-3 |
A partir de là on regarde, comme d'habitude, si
la réaction d'hydrolyse acide de l'anion dihydrogénocitrate
est de nature à modifier le pH de la solution:
H2Ci- + H2O  HCi2-
+ H3O+
La constante de cet équilibre est égale à
Ka2, soit numériquement 1.74.10-5 à
25°C.
HCi2-
+ H3O+
La constante de cet équilibre est égale à
Ka2, soit numériquement 1.74.10-5 à
25°C.
Comme d'habitude, on fera un tableau en indiquant, avant
et après instauration de ce second équilibre, les concentrations,
exprimées en mol.L-1, des diverses espèces dissoutes:
|
H2Ci- |
H3O+ |
HCi2- |
| Avant instauration de l'équilibre acido-basique caractérisé
par Ka2. |
0.064 |
0 |
9.47.10-3 |
| Après instauration de l'équilibre acido-basique caractérisé
par Ka2. |
0.064 - x |
x |
9.47.10-3 + x |
On arrive alors devant l'équation du second degré
suivante:
Ka2 = 1.74.10-5 = 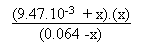 On arrive à l'équation du second degré
suivante:
x2 + 9.49.10-3.x - 1.114.10-6
= 0
On résout et on arrive à un pH de 3.94.
On arrive à l'équation du second degré
suivante:
x2 + 9.49.10-3.x - 1.114.10-6
= 0
On résout et on arrive à un pH de 3.94.
Avec la formule magique des hydrogénosels on avait
trouvé un pH de 3.92.
On peut donc considérer légitimement que
l'hydrolyse acide de l'anion dihydrogénocitrate H2Ci-
n'intervient
pas de façon substantielle pour modifier le pH fourni par la formule
magique des hydrogénosels.
Si l'on veut calculer le pH de la solution en n'importe
quel point de la courbe compris entre V = 0 et V = 20 mL on pourra résoudre
l'équation du second degré suivante, qui n'est rien d'autre
qu'une réécriture de l'équation d'électroneutralité:
(V0 + V).h2 + [Ka1.(V0
+ V) + Cb.V].h + Ka1.(Cb.V - C0.V0) =
0
Deuxième partie de la courbe: entre V = 20 et V
= 40 mL, soit entre V/Ve = 1 et V/Ve = 2.
L'équation du dosage est alors la suivante:
H2Ci- + HO-  HCi2-
+ H2O
La constante de réaction Kr est égale
au rapport de Ka2 sur Ke, soit numériquement, à
25°C 1.74.109.
HCi2-
+ H2O
La constante de réaction Kr est égale
au rapport de Ka2 sur Ke, soit numériquement, à
25°C 1.74.109.
Si l'aspect cinétique va dans le même sens
que l'aspect thermodynamique alors la réaction est quantitative
et fortement déplacée vers la droite. C'est ce qu'on constate
d'ailleurs expérimentalement.
Etant donné que le dihydrogénocitrate de
sodium subit une très faible réaction d'hydrolyse en hydrogénocitrate
et ion hydronium, on pourra considérer que cette réaction
de dosage de l'anion dihydrogénocitrate par la soude est en fait
la réaction prépondérante: on pourra alors considérer
qu'on est dans le domaine de HENDERSON et que le pH du milieu sera calculable
facilement grâce à la constante Ka2 écrite
sous sa forme littérale et dont on aura pris le logarithme décimal.
Je n'aime pas vraiment cette méthode mais je la donne en complément:
tous les chemins menant à Rome...
On comparera les valeurs fournies par cette approximation
avec la méthode plus complète qui implique la résolution
de l'équation d'électroneutralité.
Avant cela on calculera la valeur du pH de la solution
lorsque le volume V de soude versée est égal à 40
mL, afin d'avoir les deux valeurs extrêmes de pH dans l'intervalle
considéré: V = 20 mL et V = 40 mL.
On se retrouva alors avec une solution aqueuse d' hydrogénocitrate
de disodium Na2HCi de concentration égale à 0.071
mol.L-1.Le pH de la solution sera encore donné, du moins
dans un premier temps, par la formule magique des hydrogénosels:
pH = 0,5.(pKa2 + pKa3)
Cette formule correspond au pH trouvé lorsqu' entre
en jeu uniquement la réaction d'amphotérisation de l'anion
hydrogénocitrate HCi2- en citrate Ci3-
et dihydrogénocitrate H2Ci-:
2 HCi2-  H2Ci-
+
Ci3-
La constante de cet équilibre d'amphotérisation
est égale au rapport des constantes d'acidité Ka3 sur
Ka2, soit numériquement à 25°C: 0.023.
H2Ci-
+
Ci3-
La constante de cet équilibre d'amphotérisation
est égale au rapport des constantes d'acidité Ka3 sur
Ka2, soit numériquement à 25°C: 0.023.
Numériquement, en appliquant la formule magique
on trouve une valeur de pH égale à 5.58.
On pourra vérifier, de la même façon
que pour le dihydrogénocitrate de sodium NaH2Ci, que
l'hydrogénosel Na2HCi ne subit pas, dans les conditions
de travail où l'on se place, de réaction d'hydrolyse conséquente
susceptible de modifier la valeur de pH trouvée par la formule magique
des hydrogénosels.
On aura à résoudre l'équation suivante:
0.023 = 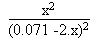 On fera un tableau présentant les résultats,
exprimés en mol.L-1, tout comme lors du cas du
dihydrogénocitrate de sodium, après instauration de cet équilibre
d'amphotérisation.
On fera un tableau présentant les résultats,
exprimés en mol.L-1, tout comme lors du cas du
dihydrogénocitrate de sodium, après instauration de cet équilibre
d'amphotérisation.
| HCi2- |
0.0545 |
| Ci3- |
8.25.10-3 |
| H2Ci- |
8.25.10-3 |
A partir de là on regardera l'influence éventuelle
sur le pH de la solution de la réaction d'hydrolyse de l'anion
hydrogénocitrate HCi2-.
HCi2- + H2O  H3O+
+ Ci3-
On présentera les évolutions des diverses concentrations,
exprimées en mol.L-1, dans un tableau:
H3O+
+ Ci3-
On présentera les évolutions des diverses concentrations,
exprimées en mol.L-1, dans un tableau:
|
HCi2- |
H3O+ |
Ci3- |
| Avant instauration de l'équilibre acido-basique caractérisé
par Ka3 |
0.0545 |
0 |
8.25.10-3 |
| Après instauration de l'équilibre acido-basique caractérisé
par Ka3 |
0.0545 - x |
x |
8.25.10-3 + x |
On aura à résoudre alors l'équation:
3.98.10-7 = 10-6.40 = 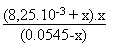 On résout alors l'équation du second degré
suivante:
x2 + 8.25.10-3.x -2.17.10-8
= 0
On arrive à un pH de 5.58.
On résout alors l'équation du second degré
suivante:
x2 + 8.25.10-3.x -2.17.10-8
= 0
On arrive à un pH de 5.58.
Avec la formule magique des hydrogénosels on trouvait
la même valeur. La réaction d'hydrolyse de l'anion hydrogénocitrate
HCi2- en citrate Ci3- n'est pas susceptible de modifier
la valeur de pH trouvée grâce à la formule magique
des hydrogénosels.
On revient au calcul des pH de la solution dans l'intervalle
considéré.
Afin de calculer le pH de la solution dans l'intervalle
considéré on sera amené à résoudre l'équation
d'électroneutralité suivante:
h + (Na+) = (H2Ci-)
+ 2.(HCi2-)
On remplacera chacun des termes par son expression littérale
et ensuite on passera à l'application numérique:
(Na+) = 
(H2Ci-) = 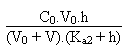
2. (HCi2-) = 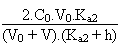 On calculera le pH par exemple lorsque V = 30 mL, bref lorsqu'on
est à V/Ve = 1.5.
On calculera le pH par exemple lorsque V = 30 mL, bref lorsqu'on
est à V/Ve = 1.5.
On est alors amené à résoudre l'équation
du second degré suivante:
130.h2 + 4.95.h -8.81.10-5 =
0
On arrive à un pH de 4.75, bref à un pH égal
à pKa2.
On aurait pu arriver à ce même résultat
en utilisant la formule de HENDERSON, applicable ici. Même si , je
le répète, j'aime beaucoup moins cette méthode par
rapport à la résolution de l'équation de l'électroneutralité.
On a alors:
pH = pKa2 + log  On aurait eu alors:
On aurait eu alors:
Equation de conservation de la masse pour l'acide citrique:
C = 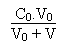 =
(H2Ci-) + (HCi2-)
Dans cette hypothèse de HENDERSON on peut négliger
le terme en citrate dans l'équation de conservation de la masse
puisqu'on considère que le seul couple acido-basique qui intervient
est celui qui est caractérisé par Ka2. C'est un
peu ce qui me gêne en fait....
(H2Ci-) =
=
(H2Ci-) + (HCi2-)
Dans cette hypothèse de HENDERSON on peut négliger
le terme en citrate dans l'équation de conservation de la masse
puisqu'on considère que le seul couple acido-basique qui intervient
est celui qui est caractérisé par Ka2. C'est un
peu ce qui me gêne en fait....
(H2Ci-) = 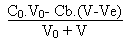
(HCi2-) = 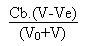 On arrive alors facilement en remplaçant chacune des
expressions dans la formule de HENDERSON par leur valeur numérique
à montrer que pH = pKa2.
On arrive alors facilement en remplaçant chacune des
expressions dans la formule de HENDERSON par leur valeur numérique
à montrer que pH = pKa2.
Je préfère encore une fois la résolution
de l'équation de l'électroneutralité à cette
méthode...
Si l'on veut calculer le pH en n'importe quel point de
la courbe compris entre V = 20 et V = 40 mL, on aura à résoudre
l'équation du second degré suivante, qui n'est autre qu'une
réécriture de l'équation de l'électroneutralité:
(V0 + V).h2 + [Ka2.(V0
+ V) + Cb.V - C0.V0].h + Ka2.(Cb.V - 2.C0.V0)
= 0
Troisième partie de la courbe: entre V/Ve = 2 et
V/Ve = 3, soit entre un volume V de soude versée égal à
40 mL et un volume égal à 60 mL.
On calculera les valeurs de pH extrêmes dans cet
intervalle.
Pour V = 40 mL on a un pH de 5.58.
Pour V = 60 mL on est en présence d'une solution
aqueuse de citrate de trisodium Na3Ci, plus communément
appelé citrate de sodium, de concentration égale à
0.0625 mol.L-1, en tenant compte du facteur de dilution introduit
par l'ajout des 60 mL de soude dans les 100 mL de solution aqueuse d'acide
citrique.
Le citrate de sodium est une polybase faible, une tribase
faible, qui adoptera un comportement de monobase faible de pKb égal
à pKb3, soit numériquement, 7.60 à 25°C.
On calculera le pH de la solution en utilisant la formule
magique des bases faibles, si tant est que le pH trouvé par cette
formule soit supérieur à pKa3 + 1.
On aura alors:
pH = 7 + 0,5.(pKa3 + log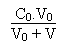 )
Numériquement cela conduit à un pH de 9.60.
)
Numériquement cela conduit à un pH de 9.60.
La valeur étant bien supérieure à
6.40 + 1, soit 7.40, on peut considérer qu'on pouvait appliquer
cette formule magique.
Le pH de la solution dans cet intervalle passera donc
d'acide à basique.
La réaction de dosage sera la suivante:
HCi2- + HO-  Ci3-
+ H2O
La constante de réaction Kr est égale
au rapport des constantes Ka3 sur Ke, numériquement on
obtient à 25°C la valeur 3.98.107.
Ci3-
+ H2O
La constante de réaction Kr est égale
au rapport des constantes Ka3 sur Ke, numériquement on
obtient à 25°C la valeur 3.98.107.
Si l'aspect cinétique va dans le même sens
que l'aspect thermodynamique, cette réaction est quantitative et
très déplacée vers la droite. C'est ce qu'on constate
d'ailleurs expérimentalement.
Pour trouver le pH de la solution pour n'importe quel
volume V de soude versée, compris dans cet intervalle, on
aura à revenir à l'équation d'électroneutralité
de la solution:
h + (Na+) = w
+ 2.(HCi2-) + 3.(Ci3-)
Le pH étant soit acide soit basique je recommande,
encore une fois, de raisonner par l'absurde.
On postule que le pH correspondant à un volume
V de soude versé est acide. On raye alors dans l'équation
d'électroneutralité w devant
h et on résout l'équation du second degré obtenue.
Si on trouve un pH acide c'est que l'hypothèse
de départ était vraie. Si au contraire on trouve un pH basique
alors c'est que l'hypothèse de départ était fausse.
On reprend l'équation de l'électroneutralité. On raye
alors h devant w et l'on résout
la nouvelle équation du second degré qui est obtenue. On
trouve alors un pH basique , en accord avec l'hypothèse de départ.
On n'a pas laissé la place au hasard dans cette démarche.
Cherchons, par exemple, à calculer le pH de la
solution lorsque le volume V de soude versée est égal à
50 mL, bref lorsqu'on est à V/Ve = 2.5.
A priori, mais ce n'est qu'un a priori, le pH devrait
être voisin de pKa3, voire égal à pKa3.
On résoudra l'équation d'électroneutralité
dans cette hypothèse en rayant w devant
h.
Les concentrations de chacune des espèces s'écrivent
alors, compte tenu des facteurs de dilution:
(Na+) = 
2.(HCi2-) = 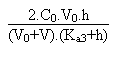
3.(Ci3-) =  On arrive alors, en remplaçant chacun des termes par
les valeurs numériques qui lui correspondent à:
150.h2 + 5.h -2.10-6 = 0
On résout et on trouve que le pH est égal à
6.40, soit un pH égal à pKa3.
On arrive alors, en remplaçant chacun des termes par
les valeurs numériques qui lui correspondent à:
150.h2 + 5.h -2.10-6 = 0
On résout et on trouve que le pH est égal à
6.40, soit un pH égal à pKa3.
Dans le cas où l'on postule que le pH de la solution,
lorsqu'on se situe entre V= 40 et V = 60 mL, est acide, si l'on veut arriver
au résultat il faut résoudre l'équation du second
degré suivante:
(V0 + V).h2 +[ Cb.V -2.C0.V0
+ (V0 + V).Ka3].h + Cb.V.Ka3 -C0.V0.Ka3
= 0
Si aucontraire on postule que le pH de la solution, toujours
pour un volume V de soude versée compris entre 40 et 60 mL, est
basique, on arrive à l'équation du second degré suivante:
(2.C0.V0 - Cb.V).h2
+ h.[3.C0.V0.Ka3 + Ke.(V0 +
V) - Cb.V.Ka3] + Ka3.Ke.(V0 + V) = 0
Quatrième partie: au-delà de V = 60 mL,
soit au-delà de V/Ve = 3.
On est alors en présence d'un mélange de
soude et de citrate de sodium. Le pH sera imposé par la base forte.
Quel est le pH de la solution lorsqu'on aura versé
un volume V de soude égal à 70 mL?
Le pH de la solution sera alors donné par la formule:
pH = 14 + log 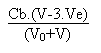 Dans le cas où V = 70 mL on trouve un pH de 12.47.
Dans le cas où V = 70 mL on trouve un pH de 12.47.
Si l'on verse un volume infiniment grand de soude dans
le milieu le pH tend , en théorie, asymptotiquement vers la valeur
du pH de la soude pure, soit 13.70. En fait, en raison de l' erreur alcaline
le pH est proche de 12....
On récapitulera tous les résultats de la
courbe de dosage d'une solution aqueuse d'acide citrique de concentration
égale à 0.1 mol.L-1 par la soude à la concentration
de 0.5 mol.L-1 dans un tableau.
| Volume V de soude versée (exprimé
en mL) |
V/Ve |
pH |
| 0 |
0 |
2.07 |
| 10 |
0.5 |
3.11 |
| 20 |
1.0 |
3.93 |
| 30 |
1.5 |
4.75 |
| 40 |
2.0 |
5.58 |
| 50 |
2.5 |
6.40 |
| 60 |
3.0 |
9.60 |
| 70 |
3.5 |
12.47 |
| infini |
infini |
13.70(en fait, l' erreur alcaline ramène le pH vers 12) |
Retour
au plan du cours sur les pH des solutions aqueuses.
IV.6. Dosage d'une
polybase faible: le carbonate de sodium.
Retour
au plan du cours sur les pH des solutions aqueuses.
Le carbonate de disodium, plus communément appelé
carbonate de sodium, a pour formule Na2CO3.
Les deux pKa de l'acide carbonique ou dioxyde de carbone
en solution aqueuse sont respectivement, à 25°C, égaux
à 6.40 et 10.30.
Ils correspondent aux couples acido-basiques suivants,
respectivement:
H2CO3 (ou CO2, H2O)
/ HCO3- et HCO3-/ CO32-.
On cherchera à calculer la courbe de dosage de
cette polybase faible.
On choisira un volume V0 égal à
100 mL et une concentration C0 en carbonate de sodium égale
à 0.1 mol.L-1.
On effectuera le dosage par une solution aqueuse d'acide
chlorhydrique H3O+ + Cl- de concentration
Ca égale à 0.5 mol.L-1.
Le volume équivalent Ve sera égal à
20 mL. Il correspondra à la première neutralisation de la
fonction basique de l'anion carbonate.
On sera alors en présence d'une solution aqueuse
d' hydrogénocarbonate de sodium, autrefois appelé bicarbonate
de soude, de formule NaHCO3, de concentration égale
à 0.083 mol.L-1, en raison du facteur de dilution introduit
par les 20 mL de solution d'acide chlorhydrique.
La seconde équivalence correspondra à un
volume d'acide versé égal à 40 mL. On sera en présence
d'un mélange de chlorure de sodium et de dioxyde de carbone en solution
aqueuse.
La courbe de dosage du carbonate de sodium sera découpée
en trois parties:
Première partie: de V = 0 à V = 20 mL,
soit de V/Ve = 0 à V/Ve = 1.
Deuxième partie: de V = 20 à V = 40 mL,
soit de V/Ve = 1 à V/Ve = 2.
Troisième partie: au-delà de V = 40 mL,
soit au-delà de V/Ve =2.
Première partie.
Nous calculerons tout d'abord le pH initial de la solution.
L'anion carbonate est susceptible de donner lieu à
divers équilibres acido-basiques.
Nous avons déjà étudié cette
question plus haut dans le cours, au niveau du paragraphe consacré
aux polybases faibles.
Nous avons donc:
CO32- + H2O  HCO3-
+
HO-
La constante de cet équilibre est Kb2,
de valeur numérique 2.10-4 à 25°C.
HCO3-
+
HO-
La constante de cet équilibre est Kb2,
de valeur numérique 2.10-4 à 25°C.
Nous avons ensuite:
HCO3- + H2O  CO2
+ HO-
La constante de cet équilibre est Kb1,
de valeur numérique 2.51.10-8 à 25°C.
CO2
+ HO-
La constante de cet équilibre est Kb1,
de valeur numérique 2.51.10-8 à 25°C.
L'application de la méthode de la réaction
prépondérante nous a permis de négliger l'apport en
quantité de matière du second équilibre et de ne considérer
que le premier.
On se retrouve donc avec une dibase faible qui adopte
un comportement de monobase faible de pKb égal à pKb2,
soit 3.70 à 25°C.
Le pH de la solution sera donné, dans un premier
temps, sous réserve de validité de la formule, par la relation
magique suivante:
pH = 7 + 0,5.(pKa2 + log C0)
Cette formule n'étant bien entendu applicable que
si le pH trouvé grâce à elle est strictement supérieur
à pKa2 + 1.
On trouve une valeur de pH qui est de 11.65. La valeur
étant supérieure à 10.3 + 1, soit 11.3, la formule
magique est applicable.
La concentration des ions hydroxyde provenant du premier
équilibre permet de montrer que seulement quelque 4.47% des
anions carbonate ont subi l'hydrolyse donnant des ions hydrogénocarbonate
et des ions hydroxyde.
On cherchera à calculer désormais le pH
de la solution lorsqu'on est à V = 20 mL, bref lorsqu'on est à
V/Ve = 1.
La réaction du dosage est la suivante:
CO32- + H3O+  HCO3-
+
H2O
La constante de réaction Kr est égale
à l'inverse de la constante Ka2. Numériquement
à 25°C on trouve une valeur égale à 2.1010.
HCO3-
+
H2O
La constante de réaction Kr est égale
à l'inverse de la constante Ka2. Numériquement
à 25°C on trouve une valeur égale à 2.1010.
Si l'aspect cinétique va dans le même sens
que l'aspect thermodynamique alors la réaction est quantitative
et très déplacée vers la formation de l'anion hydrogénocarbonate.
C'est ce que l'on constate expérimentalement par ailleurs.
On aura alors à calculer le pH d'une solution
d'hydrogénocarbonate de sodium NaHCO3 de concentration
égale à 0.083 mol.L-1. C'est un hydrogénosel.
L'anion hydrogénocarbonate subit la réaction
désormais bien connue d'amphotérisation acido-basique suivante:
2 HCO3-  CO32-
+ H2CO3
La constante d'équilibre de la réaction d'amphotérisation
est égale au rapport des constantes d'acidité Ka2
sur Ka1. Numériquement on trouve une valeur égale
à 1.26.10-4.
CO32-
+ H2CO3
La constante d'équilibre de la réaction d'amphotérisation
est égale au rapport des constantes d'acidité Ka2
sur Ka1. Numériquement on trouve une valeur égale
à 1.26.10-4.
Une fois cet équilibre d'amphotérisation
établi les concentrations en diverses espèces présentes
dans la solution sont calculées grâce à l'équation
suivante:
1.26.10-4 = 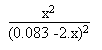 On aura alors le tableau suivant, avec des concentrations
exprimées en mol.L-1:
On aura alors le tableau suivant, avec des concentrations
exprimées en mol.L-1:
| HCO3- |
0.081 |
| CO32- |
9.50.10-4 |
| H2CO3 |
9.50.10-4 |
Le pH de la solution sera donné dans une première
approche par la formule magique des hydrogénosels:
pH = 0,5.(pKa1 + pKa2)
Numériquement on trouve un pH de 8.35 grâce
à cette formule magique.
Peut-on lui faire confiance?
Il faut rechercher si l'on n'a pas une réaction
secondaire, la réaction d'hydrolyse de l'anion hydrogénocarbonate,
qui serait de nature à modifier la valeur de pH trouvée par
cette formule.
La réaction susceptible d'être concurentielle
est la suivante:
HCO3- + H2O  CO2
+
HO-
La constante d'équilibre de cette réaction
a pour valeur Kb1, soit 2.51.10-8 à 25°C.
CO2
+
HO-
La constante d'équilibre de cette réaction
a pour valeur Kb1, soit 2.51.10-8 à 25°C.
Nous présenterons le tableau suivant qui fera
figurer, exprimées en mol.L-1, les évolutions
des diverses concentrations des espèces dissoutes, avant et
après instauration de l'équilibre d'hydrolyse de l'anion
hydrogénocarbonate.
|
HCO3- |
H2CO3 |
HO- |
| Avant instauration de l'équilibre d'hydrolyse de l'anion hydrogénocarbonate |
0.081 |
9.50.10-4 |
0 |
| Après instauration de l'équilibre d'hydrolyde de l'anion
hydrogénocarbonate |
0.081 - x |
9.50.10-4 + x |
x |
On résoudra alors l'équation suivante:
2.51.10-8 = 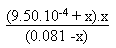 On résout alors l'équation du second degré
suivante:
x2 + 9.50.10-4.x - 2.03.10-9
= 0
On trouve x = 2.13.10-6 mol.L-1. On
en déduit que la concentration des ions hydronium est égale
à 4.69.10-9, ce qui donne un pH de 8.33.
On résout alors l'équation du second degré
suivante:
x2 + 9.50.10-4.x - 2.03.10-9
= 0
On trouve x = 2.13.10-6 mol.L-1. On
en déduit que la concentration des ions hydronium est égale
à 4.69.10-9, ce qui donne un pH de 8.33.
Avec la formule magique on trouvait un pH de 8.35. On
voit numériquement que la réaction d'hydrolyse de l'anion
hydrogénocarbonate n'est pas de nature à modifier de façon
conséquente la valeur du pH. On est en présence ici d'un
"bon" hydrogénosel, à la solution aqueuse dont le pH
est indépendant de la concentration. C'est d'ailleurs le cas le
plus fréquent.
On cherchera à calculer, désormais, les
valeurs de pH comprises entre V/Ve = 0 et V/Ve = 1.
On aura à résoudre l'équation d'
électroneutralité de la solution:
(Na+) = w
+ (HCO3-) + 2.(CO32-) + (Cl-)
On a négligé les ions hydronium devant les
ions hydroxyde dans cet intervalle de pH car on se situe forcément
en milieu basique: 8.35 est bien un pH basique.
On aura, en fonction du volume d'acide chlorhydrique
versé:
(Na+) = 2. 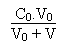
(Cl-) = 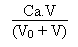
(HCO3-) = 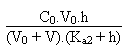
2.(CO32-) = 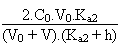 En réarrangeant (sans se tromper si possible!)
tous les termes on arrive à une équation du second degré
en h, à partir de laquelle on trouvera le pH de la solution,
entre V/Ve = 0 et V/Ve = 1, pour tout volume V d'acide chlorhydrique versé:
h2.(Ca.V - C0.V0)
+ h.[Ca.Ka2.V + Ke.(V0 + V)] + Ke.Ka2.(V0
+ V) = 0
Prenons le cas où V = 10 mL, bref lorsqu'on est à
V/Ve = 0.5.
En réarrangeant (sans se tromper si possible!)
tous les termes on arrive à une équation du second degré
en h, à partir de laquelle on trouvera le pH de la solution,
entre V/Ve = 0 et V/Ve = 1, pour tout volume V d'acide chlorhydrique versé:
h2.(Ca.V - C0.V0)
+ h.[Ca.Ka2.V + Ke.(V0 + V)] + Ke.Ka2.(V0
+ V) = 0
Prenons le cas où V = 10 mL, bref lorsqu'on est à
V/Ve = 0.5.
Nous arrivons alors à l'équation du second
degré suivante:
-5.h2 + 2.52.10-10.h + 4.38.10-23
= 0
On trouve un pH de 10.32, bref on trouve pH = pKa2.
Deuxième partie: entre V = 20 et V = 40 mL, soit
entre V/Ve = 1 et V/Ve = 2.
La réaction de dosage qui a lieu est la suivante:
HCO3- + H3O+  CO2
+ 2H2O
La constante de réaction Kr est égale
à 2.51.106, soit à l'inverse de la constante Ka1.
CO2
+ 2H2O
La constante de réaction Kr est égale
à 2.51.106, soit à l'inverse de la constante Ka1.
Si l'aspect cinétique est en accord avec l'aspect
thermodynamique la réaction est très favorisée de
la gauche vers la droite. C'est ce qu'on observe expérimentalement.
On calculera le pH lorsque V = 40 mL, bref lorsque V/Ve
est égal à 2.
On sera alors en présence d'une solution aqueuse
de dioxyde de carbone, mélangé à du chlorure de sodium.
Le pH de la solution sera celui imposé par le
dioxyde de carbone dissous.
La concentration C de ce dernier sera égale à:
C = 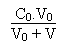 soit numériquement 0.071 mol.L-1, en tenant
compte du facteur de dilution introduit par les 40 mL de solution d'acide
versé dans les 100 mL initiaux.
soit numériquement 0.071 mol.L-1, en tenant
compte du facteur de dilution introduit par les 40 mL de solution d'acide
versé dans les 100 mL initiaux.
Le dioxyde de carbone dissous se comportera en pratique
comme un monoacide faible de constante d'acidité Ka égale
à Ka1. En effet la seconde acidité est négligeable
devant la première.
On aura à résoudre l'équation du
second degré en h issue de l'égalité suivante:
Ka1 = 3.98.10-7 =  Soit l'équation:
h2 + 3.98.10-7.h -2.83.10-8
= 0
On résout et on trouve un pH de 3.77.
Soit l'équation:
h2 + 3.98.10-7.h -2.83.10-8
= 0
On résout et on trouve un pH de 3.77.
Entre V/Ve = 1 et V/Ve = 2 le pH de la solution sera soit
basique, soit acide.
Il faudra résoudre à chaque fois l'équation
de l'électroneutralité de la solution et faire un raisonnement
par l'absurde.
L'équation sera la suivante:
(Na+) + h = w
+ (HCO3-) + (Cl-)
On aura:
(Na+) = 2.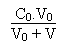
(HCO3-) = 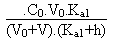
(Cl-) = 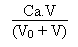 A partir de là, si l'on postule que le pH de la solution
est basique, pour un volume V de solution aqueuse d'acide chlorhydrique
versé, on arrive à l'équation du second degré
suivante:
(Ca.V -2.C0.V0).h2
+ h.[Ke.(V0 + V) + Ka1.(Ca.V - 2.C0.V0)]
+ Ka1.Ke.(V0 + V) = 0
Si au contraire on postule que le pH est acide alors on sera
amené à résoudre l'équation du second degré
suivante:
(V0 + V).h2 + [Ka1.(V0
+
V) + 2.C0.V0 - Ca.V].h + Ka1.(C0.V0
- Ca.V) = 0
Exemple: calcul du pH de la solution lorsque le volume V
d'acide chlorhydrique versé est égal à 30 mL, bref
lorsqu'on est à V/Ve = 1.5.
A partir de là, si l'on postule que le pH de la solution
est basique, pour un volume V de solution aqueuse d'acide chlorhydrique
versé, on arrive à l'équation du second degré
suivante:
(Ca.V -2.C0.V0).h2
+ h.[Ke.(V0 + V) + Ka1.(Ca.V - 2.C0.V0)]
+ Ka1.Ke.(V0 + V) = 0
Si au contraire on postule que le pH est acide alors on sera
amené à résoudre l'équation du second degré
suivante:
(V0 + V).h2 + [Ka1.(V0
+
V) + 2.C0.V0 - Ca.V].h + Ka1.(C0.V0
- Ca.V) = 0
Exemple: calcul du pH de la solution lorsque le volume V
d'acide chlorhydrique versé est égal à 30 mL, bref
lorsqu'on est à V/Ve = 1.5.
On postulera que le pH est a priori acide et même
égal à pKa1, soit 6.4 à 25°C.
On aura alors à résoudre l'équation
du second degré suivante:
130.h2 + 5.h -2.10-6 = 0
On arrive bien à pH = pKa1, soit 6.40.
Troisième partie: au-delà de V/Ve = 2, soit
au-delà de V = 40 mL.
On se retrouvera alors en excès d'acide chlorhydrique.
ce sera lui qui imposera le pH de la solution.
On aura alors:
(H3O+) = 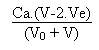 Si l'on verse par exemple un volume V d'acide chlorhydrique
égal à 50 mL, le pH de la solution sera égal à
1.48.
Si l'on verse par exemple un volume V d'acide chlorhydrique
égal à 50 mL, le pH de la solution sera égal à
1.48.
Si l'on verse un volume infini d'acide le pH de la solution
tendra vers 0.3.
On récapitulera les résultats du dosage
de 100 mL d'une solution aqueuse de carbonate de sodium à 0.1 mol.L-1
par l'acide chlorhydrique à 0.5 mol.L-1 dans un tableau.
| Volume V d'acide chlorhydrique versé (mL) |
V/Ve |
pH |
| 0 |
0 |
12.65 |
| 10 |
0.5 |
10.30 (pKa2) |
| 20 |
1.0 |
8.35 |
| 30 |
1.5 |
6.40 (pKa1) |
| 40 |
2.0 |
3.77 |
| 50 |
2.5 |
1.48 |
| infini |
infini |
0.30 |
Retour
au plan du cours sur les pH des solutions aqueuses.
Suite
du cours sur les pH des solutions aqueuses. Cliquer ici.