Retour au plan du cours sur les pH des solutions aqueuses.
III.1. Définition de la réaction de "salification" ou de "neutralisation" acidobasique.
Retour au plan du cours sur les pH des solutions aqueuses.
Lorsqu'on considère un acide HA, présent
à la concentration C0, dans une solution aqueuse de volume
V0, et qu'on verse dans la solution la même quantité
de matière, exprimée en mole, d'une base, on obtient la "salification"
de l'acide, ou sa "neutralisation".
L'équation chimique de la réaction est:
Si l'acide HA est faible l'équation chimique de la salification sera bien toujours:
Retour au plan du cours sur les pH des solutions aqueuses.
III.2.Calcul du pH des sels d'acide fort et de base forte.
Retour au plan du cours sur les pH des solutions aqueuses.
On dispose d'un volume V0 égal à
100 mL d'une solution d'acide chlorhydrique de concentration C0
égale à 0.1 mol.L-1 qu'on veut neutraliser par
de la soude de concentration Cb égale à 0.5 mol.L-1.
On demande quelle est l'équation chimique qui
a lieu lors de la salification.
On demande quelle est la masse de sel formé,si
l'on évapore l'eau résiduelle, sachant que les masses molaires,
exprimées en g.mol-1, sont respectivement pour le sodium
Na et le chlore Cl, 23 et 35.45.
L'équation chimique est évidemment:
Que vaudra le pH juste à la salification?
Il faut faire le bilan des espèces présentes,
en genre et en concentration, du moins quand c'est possible.
Il faut écrire ensuite l'électroneutralité
de la solution.
On simplifie si possible l'électroneutralité
et on essaie de conclure.
Bilan des ions présents lors de la salification:
Na+, Cl-, H3O+ et HO-.
La concentration des ions Na+ est égale à: ![]() ,
avec Cb qui vaut 0.5 mol.L-1, Ve qui vaut 20 mL et V0
qui vaut 100 mL.
,
avec Cb qui vaut 0.5 mol.L-1, Ve qui vaut 20 mL et V0
qui vaut 100 mL.
La concentration des ions chlorure Cl- est
égale
à: ![]() ,
avec C0 qui vaut 0.1 mol.L-1.
,
avec C0 qui vaut 0.1 mol.L-1.
A partir de là on écrit lélectroneutralité
de la solution:
Le pH des sels d'acide fort et de base forte vaut 7 à 25°C.
Retour au plan du cours sur les pH des solutions aqueuses.
III.3. Calcul du pH d'un sel de base forte et d'acide faible.
Retour
au plan du cours sur les pH des solutions aqueuses.
On dispose d'une solution d'acide éthanoïque
de concentration C0 égale à 0.1 mol.L-1
, de volume V0 égal à 100 mL, qu'on neutralise
exactement par de la soude de concentration Cb égale à 0.5
mol.L-1.
Le pKa de l'acide éthanoïque vaut 4.75 à
25 °C.
On demande les mêmes questions que pour l'exemple
précédent d'un sel de base forte et d'acide fort.
L'équation de salification est la suivante:
Nous écrirons l'équation d'électroneutralité de la solution afin d'accéder au pH lors de l'équivalence.
A l'équivalence acidobasique, bref à la
neutralisation, à la salification, on a la concentration globale
des espèces CH3CO2H et CH3CO2-
qui
est devenue égale à ![]() ,
du fait de la dilution apportée par les 20 mL de soude dans les
100 mL initiaux de solution acide.C'est ce qu'on appellera la concentration
"corrigée" de l'acide éthanoïque.On la notera C0'
,
du fait de la dilution apportée par les 20 mL de soude dans les
100 mL initiaux de solution acide.C'est ce qu'on appellera la concentration
"corrigée" de l'acide éthanoïque.On la notera C0'
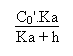
On reconnaît là une expression identique à celle du calcul du pH d'une monobase faible.
En remplaçant numériquement chacune des valeurs littérales par leur valeur numérique, sachant que (Na+) vaut 0.083 mol.L-1 ici, que Ka vaut 1.78.10-5, que Ke vaut 10-14, que C0' vaut 0.083 mol.L-1, on arrive à l'équation du second degré suivante:
On reconnaît ici encore mieux l'équation
du second degré caractéristique des monobases faibles:
le terme devant h2 est égal à
C, concentration de la monobase faible, le terme devant h est égal
à -Ke et la constante vaut -Ka.Ke.
Il y a identité parfaite des deux calculs...
Tous calculs faits on arrive à un pH de 8.83.
Pouvait-on calculer cette valeur à l'aide de la formule approchée des monobases faibles?
On essaie d'appliquer pH = 7 + 0,5.(pKa + logC0').
Cette formule n'étant applicable, rappelons-le encore une fois,
que si le pH trouvé grâce à elle est supérieur
à pKa +1.
Numériquement nous avons pH cherché = (?)
7 + 0,5.(4.75 + log0.083)
Nous trouvons pH = 8.83.
La valeur étant très supérieure
à 5.75, c'est à dire à pKa + 1 nous pouvions appliquer
cette formule rapide...
En conclusion on dira que le pH d'un sel d'acide faible et de base forte se ramène tout simplement au calcul du pH d'une monobase faible puisque ce sel a un comportement acidobasique de monobase faible.
Retour au plan du cours sur les pH des solutions aqueuses.
III.4.Calcul du pH à l'équivalence acidobasique d'un sel d'acide fort et de base faible.
Retour au plan du cours sur les pH des solutions aqueuses.
On cherchera à calculer à l'équivalence
acidobasique, à la neutralisation, à la salification, le
pH d'une solution aqueuse d'ammoniaque de volume V0 égal
à 100 mL, de concentration C0 égale à 0.1
mol.L-1, neutralisée par une solution aqueuse d'acide
chlorhydrique de concentration Ca égale à 0.5 mol.L-1.
On posera, par commodité, les mêmes questions
que pour les calculs précédents du pH de sels d'acide fort
et de base forte, ainsi que de base forte et d' acide faible.
On rappellera que le pKa du couple ammonium/ammoniac
NH4+ / NH3 vaut 9.25 à 25°C
et que Ke constante de l'équilibre d'autoprotolyse de l'eau vaut
10-14, toujours à 25°C.
L'équation de salification s'écrit:
On écrira l'équation d'électroneutralité de la solution:
En conclusion on dira que le pH d'un sel d'acide fort et de base faible a le même comportement au niveau du pH qu'un monoacide faible.
Retour au plan du cours sur les pH des solutions aqueuses.
III.5.Calcul du pH d'un sel d'acide faible et de base faible.
Retour au plan du cours sur les pH des solutions aqueuses.
On prendra l'exemple de la salification de 100 mL
d'une solution d' acide éthanoïque, acide faible de pKa égal
à 4.75 à 25°C, de concentration Ca égale à
0.1 mol.L-1, par une solution aqueuse d'ammoniaque, de concentration
égale à 0.5 mol.L-1.On rappellera que la constante
d'autoprotolyse de l'eau vaut 10-14 à 25°C et que
le pKa du couple ammonium/ ammoniac NH4+/ NH3
est de 9.25 toujours à 25°C.
L'équation de salification s'écrit:
La constante de réaction est égale à
104.50, c'est à dire au rapport de la constante d'acidité
de l'acide éthanoïque par la constante d'acidité de
l'ion ammonium.
La réaction est donc quantitativement déplacée
vers la formation d'éthanoate d'ammonium si, bien entendu,
la cinétique de la réaction le permet.
La quantité d'éthanoate d'ammonium qu'on
peut espérer recueillir après évaporation de l'eau
est de 0.01 mol.
La masse de sel obtenue est donc de 0.77g étant
donné que la masse molaire de l'éthanoate d'ammonium est
de 77 g.mol-1.
Au niveau des propriétés acidobasiques
comment se comportera le sel obtenu?
On se retrouve donc avec une solution aqueuse d'éthanoate
d'ammonium de concentration égale à 0.083 mol.L-1.
On recherchera la réaction prépondérante.
L'anion éthanoate peut réagir avec l'eau
pour régénérer de l'acide éthanoïque et
des ions hydroxyde. La constante de cette réaction est égale
à Kb du couple acide éthanoïque/ion éthanoate,
soit 10-9.25, c'est à dire 5.62.10-10 à
25°C.
Le cation ammonium peut réagir avec l'eau afin
de régénérer une faible quantité d'ammoniac
dissopus dans l'eau et des ions hydronium. la constante de cet équilibre
est égale à 10-9.25 , c'est à dire 5.6.10-10
à 25°C.
Enfin le cation ammonium peut réagir sur l'anion
éthanoate afin de régénérer une faible quantité
d'acide éthanoïque et d'ammoniac dissous.
L'équilibre est alors:
| CH3CO2- | NH4+ | CH3CO2H | NH3 | |
| Moment initial | 0.083 | 0.083 | 0 | 0 |
| Moment final, une fois les équilibres acidobasiques réalisés | 0.083-x | 0.083-x | x | x |
A partir de là on est amené à résoudre
, soit une équation du second degré, soit, plus simplement
encore, en prenant la racine carré de l'expression précédente,
une simple équation du premier degré.
Pour l'équation du second degré il faut
résoudre:
3.16.10-5 = ![]()
Pour l'équation du premier degré il suffit
de prendre la racine de l'expression précédente.
On arrive à x = 4.64.10-4.
A partir de la constante d'acidité Ka de
l'acide éthanoïque, vu qu'on connaît Ka, qu'on connaît
également (CH3CO2H) et (CH3CO2-),
on isole h et on arrive à pH 7.
On puvait trouver le même résultat avec
la constante d'acidité de l'ion ammonium ou en appliquant la formule
magique pH = 0,5.(pKa1 + pKa2).
Si à partir du bilan de matière de la réaction
prépondérante on avait cherché une réaction
prépondérante secondaire susceptible de jouer les trublions
au niveau du pH, et de rendre inapplicable la formule magique?
Le cation ammonium est alors susceptible de réagir
avec l'eau pour donner un équilibre de constante Ka = 10-9.25
créant des ions hydronium et régénérant de
l'ammoniac:
| NH4+ | NH3 | H3O+ | |
| Instant initial | 0.083- 4.64.10-4, soit 0.083 | 4.64.10-4 | 0 |
| Instant final | 0.083-x | 4.64.10-4 + x | x |
On résout une équation du second degré:
A titre d'exercice on pourra s'amuser à calculer
le pH d'une solution aqueuse de cyanure d'ammonium et d'une solution aqueuse
de méthanoate d'ammonium, toutes deux ayant pour concentration la
valeur 0.083 mol.L-1.
Les pKa des couples acide cyanhydrique/anion cyanure
HCN/CN- et acide méthanoïque/ anion méthanoate
HCO2H/HCO2- valent respectivement
9.30 et 3.80 à 25°C.
Retour
au plan du cours sur les pH des solutions aqueuses.
III.6.Le cas du pH des solutions aqueuses d'hydrogénosels.
Retour au plan du cours sur les pH des solutions aqueuses.
On obtient en chimie un "hydrogénosel" lorsqu'on neutralise incomplètement, mais dans d'exactes proportions stoechiométriques toutefois, toutes les acidités d'un polyacide par une base, ou, inversement, lorsqu'on neutralise incomplètement , dans les mêmes conditions que précédemment, une polybase par un acide.
Je vais donner divers exemples:
Prenons le cas d'une solution aqueuse d'acide phosphorique,
triacide minéral de formule H3PO4, de concentration
égale à 0.1 mol.L-1 qu'on neutralise par la soude à
0.5 mol.L-1 uniquement au tiers.
La réaction de salification s'écrira alors:
Si au contraire on avait voulu neutraliser aux deux tiers
l'acide phosphorique il aurait fallu verser un volume de soude dans la
solution initiale d'acide phosphorique qui aurait été de
40 mL.
La réaction de neutralisation aux deux tiers de
l'acide phosphorique aurait été alors:
Si au contraire on avait voulu neutraliser aux trois tiers,
bref complètement, l'acide phosphorique, on aurait dû verser
dans la solution une quantité de soude égale à 60
mL.
La réaction aurait été :
En conclusion on dira que le dihydrogénophosphate de sodium ainsi que l' hydrogénophosphate de sodium sont des "hydrogénosels" car leur formule chimique renferme des atomes de l'élément hydrogène susceptibles d'avoir des réactions acidobasiques. Ce sont donc des atomes de l'élément hydrogène qui sont "labiles" du point de vue acidobasique.Ils peuvent soit partir soit revenir...
En revanche le phosphate de sodium n'est pas un "hydrogénosel" car il ne contient dans sa formule chimique aucun atome de l'élément hydrogène qui soit labile du point de vue acidobasique.
Reprenons l'exemple du dihydrogénophosphate de
sodium préparé lors de la neutralisation au tiers d'une solution
d'acide phosphorique de volume 100 mL, de concentration égale
à 0.1 mol.L-1 , par la soude à 0.5 mol.L-1.
La concentration de l'hydrogénosel est alors de
0.083 mol.L-1.
Le cation sodium est indifférent. il n'a aucune
influence sur la valeur du pH de la solution d'hydrogénosel.
L'anion dihydrogénophosphate est susceptible,
quant à lui, de réagir selon plusieurs possibilités:
Suite du cours sur les pH des solutions aqueuses. Cliquer ici.