Principes
et formules de base:
Retour au plan du cours de
méthodologie.
Formules des acides minéraux
(hydracides
et oxacides) ainsi qu'organiques à connaître:
1. Hydracides (i.e. dont les anions
sont
exempts d'atomes d'oxygène): chlorhydrique, bromhydrique,
iodhydrique, fluorhydrique, cyanhydrique, sulfhydrique.
REM: i.e, en latin "id est", c'est à dire
"c'est à dire"!
2. Oxacides (i.e. dont les anions
contiennent un
ou plusieurs atomes d'oxygène): sulfureux, sulfurique, nitreux,
nitrique, phosphorique.
3. Acides organiques:
méthanoïque (alias
formique,
du latin "formica", fourmi !), éthanoïque (alias acétique,
principe actif du vinaigre), acétyl salicylique, picrique
(alias 2,4,6 trinitro phénol).
Formules des bases à connaître:
Hydroxyde de sodium (alias soude), hydroxyde de
potassium
(alias potasse), hydroxyde de baryum (alias baryte), hydroxyde de
calcium
(alias eau de chaux), ammoniaque, aniline...
Formules générales des
sels
à connaître, à savoir écrire:
1. Sels cristallisés anhydres: chlorure de
sodium,
chlorure de potassium....
2. Sels cristallisés hydratés: sulfate
de
cuivre (II) pentahydraté; sulfate double de fer(II) et
d'ammonium
hexahydraté, alias "sel de MOHR"....
3. Sels dissous, en solution aqueuse: chlorure
de
sodium, sulfate de fer (III)....
Nomenclature en chimie minérale (alias
inorganique)
et organique. Quelques rappels.
Nomenclature des hydracides et des anions
dérivés:
Pour les hydracides: au radical du
nom on
ajoute
le
suffixe
"hydrique".
C'est l'exemple de l'acide "chlorhydrique", de
l'acide "bromhydrique", de l'acide "cyanhydrique".....
Pour les anions dérivés: au radical
du nom on ajoute le suffixe "ure".
C'est l'exemple de l'anion "chlorure", de
l'anion
"bromure", de l'anion "cyanure"....
Nomenclature des oxacides et de leurs anions
dérivés:
Pour les oxacides il y a deux
terminaisons:
en "eux" ou en "ique".
Pour un élément donné la
terminaison "eux" contiendra moins d'atomes de
l'élément
oxygène que la terminaison "ique".
C'est "simple"!!!!! (Rires!!!!!)...
En général on a, dans l'ordre
croissant
du nombre d'atomes d'oxygène, la séquence suivante, pour
un élément donné, quand ces acides existent
réellement,
ce qui n'est pas toujours le cas!!!!!
Le cas le plus simple est celui des acides
dérivant
de l'élément chlore.
On a la séquence suivante:
Acide hypochloreux, HClO. Préfixe
"hypo", qui veut dire "en dessous";radical "chlor";
suffixe
"eux"; 1 seul atome d'oxygène, 1 atome de chlore.
Acide chloreux, HClO2. Préfixe
absent; radical "chlor"; suffixe "eux";
2
atomes d'oxygène, 1 atome de chlore.
Acide chlorique, HClO3. Préfixe
absent; radical "chlor"; suffixe "ique";
3
atomesd'oxygène, 1 atome de chlore.
Acide perchlorique, HClO4.
Préfixe"per",
qui veut dire "au maximum"; radical
"chlor";
suffixe
"ique";
4
atomes d'oxygène, 1 atome de chlore.
Pour les anions dérivant des oxacides
précédents on a deux terminaisons qui sont "ite"
et "ate".
Pour les oxacides se terminant par "eux"
la
terminaison de l'anion , ou des anions correspondant(s)
sera "ite".
Pour les oxacides se terminant par "ate"
la
terminaison de l'anion, ou des anions,
correspondant(s)
sera "ate".
Bien entendu, conformément à ce qui a
été
signalé au sujet des oxacides en "eux" et des oxacides
en
"ate", pour un élément donné, on
aura
les anions en "ite" qui contiendront moins d'atomes
de
l'élément oxygène que les anions en "ate".
Prenons le cas des deux oxacides
dérivant
de
l'élément azote, les acides "nitreux"
HNO2
et "nitrique", HNO3.
Les anions dérivés seront
alors,
respectivement:
Anion "nitrite", NO2-,
pour l'acide "nitreux", HNO2.
Anion "nitrate", NO3-,
pour l'acide "nitrique", HNO3.
Reprenons la série des oxacides
dérivant
de l'élément chlore, on aura alors la
correspondance
suivante:
Acide hypochloreux HClO donne
anion
"hypochlorite",
ClO-.
Acide chloreux HClO2 donne anion
"chlorite", ClO2-.
Acide chlorique HClO3donne anion
"chlorate",
ClO3-.
Acide perchlorique HClO4donne
anion
"perchlorate", ClO4-.
Pour d'autres anions usuels, par exemple l'anion sulfate,
on n'a pas encore trouvé un moyen "simple" de les
désigner
de façon systématique .
Un essai est signalé cependant dans
certaines
"recommandations" de l' U.I.C.P.A. mais, à ma
connaissance
, il n'a jamais trouvé "preneur": l'anion sulfate serait
considéré comme dérivant formellement du
cation
soufre (VI) S6+ entouré de quatre
anions
oxyde O2-. On l'appellerait alors (!!!) tétroxosulfate
(VI)....
La nomenclature simple en "sulfate" a sans
doute encore de beaux jours devant elle.
Nomenclature des ions simples
(essentiellement
monoatomiques ) dérivant des métaux.
Il y a eu, fort heureusement, de sacrées
simplifications.
Prenons les ions monoatomiques dérivant des
atomes
de l'élément fer, Fe.
Il y a l'ion Fe2+ et l'ion Fe3+.
On les appellera tout simplement , respectivement, ion
"fer (II)" et ion "fer (III)".
Cela évitera le supplice d'antan qui
consistait
à les appeler respectivement "ferreux" et "ferrique".
Cette heureuse simplification est venue car, si l'on
considère
les ions monoatomiques simples dérivant des atomes de
l'élément
cuivre Cu, à savoir les ions Cu+ et Cu2+,
on les appelait autrefois, respectivement "cuivreux" et "cuivrique".
En les nommant plus simplement , comme aujourd'hui,
ion
" cuivre (I)" et ion "cuivre (II)", on voit tout
de
suite leur valence.
En effet, en comparant les cas du cuivre
et du fer, vous remarquerez que la terminaison "eux"
ne signifie univoquement "valence 2" ou "valence 1 " et que la
terminaison
"ique" ne signifie non plus univoquement "valence 3" ou "valence
2" . Il n' y a aucune corrélation.
Comme il n'y avait aucun lien
entre
valence
de l'ion et son nom et ce, d'un
élément
chimique à l'autre, alors on a tout ramené à
une
nomenclature indiquant clairement et sobrement: le nom de
l'élément
et , entre parenthèses, la valence de l'ion.
Lorsque la valence d'un cation métallique est
en
général unique et "célèbre" ,
je pense au cas du cation sodium Na+, ou à
celui
du cation aluminiumAl3+, on désigne les
cations
très simplement, soit cation sodium soit, mais c'est
rare,
par Na(I). Idem pour l'aluminium: on écrit
rarement
cation Al (III)....
Pour les ions simples polyatomiques
dérivant
des métaux, mais ne contenant qu'un seul
élément
chimique, on aura l'exemple du cation formé par la dimérisation
de l'ion mercure (I), Hg+.
Cet ion a pour formule Hg22+.
On l'appellera cation "dimercure (II)".
Il se forme suivant la réaction:
2 Hg + 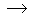 Hg22+
Hg22+
On ne le confondra surtout pas avec le cation
Hg2+,
qui lui, est appelé cation "mercure (II)"!!!!!!!
Pour les anions dérivant des métaux
là
aussi il y a eu une "simplification", quoique, une difficulté
peut
encore en chasser une autre...
Je prends l'exemple de deux anions
célèbres
dérivant des ions Fe2+ et Fe3+,
à savoir les anions "ferrocyanure" et "ferricyanure".
Ce sont leurs noms "anciens".
L'anion "ferrocyanure" résulte de la
réaction
entre un ion Fe(II) et six anions "cyanure"
CN-.
Soit, la réaction: Fe 2+ + 6
CN-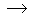 Fe(CN)64-.
Fe(CN)64-.
On appellera aujourd'hui l'anion "ferrocyanure"
anion "hexacyanoferrate(II)".
Est-ce plus simple que "ferrocyanure"?
Je trouve , en tout cas, que cet appel
à
des préfixes tels que "hexa", à la valence
de l'ion central, ici la valence 2 pour le fer, est
malgré
tout plus commode.
La terminaison "ate" signifie que la charge
globale
de l 'ion complexe est négative, que c'est donc un anion.
Avec la nomenclature en "ferrocyanure" ou "ferricyanure"
on avait parfois du mal à se rappeler au bon moment lequel
était
lequel....
Pour l'anion "ferricyanure" la
réaction
de formation est:
Fe3+ + 6CN-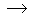 Fe(CN)63-.
Fe(CN)63-.
On appellera , en conséquence, l'anion "ferricyanure"
anion "hexacyanoferrate (III)".
On retrouvera le préfixe "hexa",
la terminaison "ate", et la valence de l'ion central,
ici
3 en l'occurence pour le fer.
Pour ce qui est de la nomenclature des
composés
organiques.
Je vous renvoie au cours
de chimie organique générale
de mon collègue G.
FEVRIER.
J'ajouterai (?) simplement qu'en chimie organique il
faut, certes connaître La bonne désignation des
molécules,
selon les règles édictées par l'Union
Internationale
de Chimie Pure et Appliquée, l' U.I.C.P.A, en
anglais
"I.U.P.A.C." , mais qu'il faut, comme en
toutes
choses, raison garder.
Je pense au cas de l'acide "éthanoïque".
C'est certes son nom "officiel", mais, si
vous
allez chez le marchand demander de l'acide "éthanoïque"
je ne suis pas si sûr qu'il sache de quoi il s'agit, surtout,
et ce n'est pas un reproche, s'il n'a pas fait spécialement
de chimie dans sa vie...
Tout le monde appelle en fait l'acide éthanoïque
acide "acétique". C'est son nom "ancien" et je
pense
qu'il n'est pas près de disparaître.
Je ne suis même pas sûr que dans tous
les
catalogues de fournisseurs il y ait une rubrique du style : "Ethanoic
acid" SEE "Acetic acid".
Il y a beaucoup de catalogues de produits chimiques qui
sont écrits en anglais, je signale...
L' "ethanoic acid" est le plus simplement du
monde...
ignoré......
Je pense également à la non moins
"célèbre"
"propanone", de formule CH3COCH3,
plus
connue chez les intimes sous le "doux nom" ... d' "acétone".
Je pense malgré tout que la nomenclature
systématique
en chimie organique a aussi eu des avantages.
Je pense encore au supplice d'autrefois au
sujet
de trois acides carboxyliques aux odeurs
épouvantables
de...
pieds
mal astiqués, et qui sont les "actuels" acides "hexanoïque",
"octanoïque" et "décanoïque".
Leurs vieux noms étaient "caprylique",
"caproïque" et... "caprique".
Si vous arrivez un jour à bien savoir lequel
est
lequel, avec les noms anciens seulement bien sûr,
au bon moment, alors on se paie un (bon) restau!!!!!
Un enfer je vous dis ces trois acides !!!!
Et ces
odeurs!!!!
Drôlement incommodantes!!!!
Résolution d'un exercice de chimie.
Comment
faire?
1. Ecrire l'équation chimique complète
qui
a lieu.
2. Faire un bilan de matière, exprimé
en
moles, sur ce qu'on possède au départ, ce qu'on obtient,
ce qui reste après réaction.
3. Donner l'expression littérale d'un calcul
avant
de passer à une quelconque application numérique.
4. Préciser les unités
employées
et, si possible, exprimer chaque unité dans le système
international.
5. Vérifier
l'homogénéité
des formules.
6. Passer au calcul numérique.
7. Vérifier la plausibilité du
résultat
obtenu: par exemple un pH négatif est forcément "faux",
de
même qu'une concentration négative, etc.....
8. Rédiger avec un minimum de phrases. Rien
de
plus déplaisant que des suites de chiffres dont on ne sait pas
d'où
ils viennent.
Ecriture des
équations
chimiques.
Retour plan du cours de
méthodologie.
Il apparaît souvent que les étudiants
ont
le plus grand mal à écrire correctement des
équations
chimiques pourtant "simples", du genre:
Acide chlorhydrique + Soude 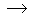 Chlorure de sodium + Eau.
Chlorure de sodium + Eau.
Outre des "horreurs" du genre:
HCl + NaOH 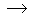 NaCl + H2O
qui ne font pas apparaître les espèces
ioniques,
forcément différentes des espèces
moléculaires,
de nombreux étudiants ont du mal à concevoir une
équation
chimique comme un ensemble de réactifs donnant un ensemble de
produits.
Ici, les réactifs sont l' acide chlorhydrique
et la soude, alias hydroxyde de sodium.
Comme ces composés sont, en solution aqueuse,
complètement dissociés, on les écrira,
respectivement:
H3O+ + Cl- et Na+ + HO-.
Les produits de la réaction sont le chlorure de
sodium et l' eau.
Le chlorure de sodium est complètement
ionisé
en solution aqueuse et s' écrira donc: Na+ + Cl-.
L' eau est essentiellement sous forme
moléculaire
et s' écrira donc: H2O.
La réaction de salification (neutralisation) s'
écrira dès lors:
H3O+ + Cl- + Na+
+ HO-
NaCl + H2O
qui ne font pas apparaître les espèces
ioniques,
forcément différentes des espèces
moléculaires,
de nombreux étudiants ont du mal à concevoir une
équation
chimique comme un ensemble de réactifs donnant un ensemble de
produits.
Ici, les réactifs sont l' acide chlorhydrique
et la soude, alias hydroxyde de sodium.
Comme ces composés sont, en solution aqueuse,
complètement dissociés, on les écrira,
respectivement:
H3O+ + Cl- et Na+ + HO-.
Les produits de la réaction sont le chlorure de
sodium et l' eau.
Le chlorure de sodium est complètement
ionisé
en solution aqueuse et s' écrira donc: Na+ + Cl-.
L' eau est essentiellement sous forme
moléculaire
et s' écrira donc: H2O.
La réaction de salification (neutralisation) s'
écrira dès lors:
H3O+ + Cl- + Na+
+ HO-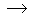 Na+
+ Cl-+ 2 H2O
Na+
+ Cl-+ 2 H2O
On rappelle que par convention on écrit
toujours
le cation avant l' anion, même si on dit "chlorure de
sodium",
et qu' on ne sépare pas le cation de son anion associé
par
d' autres espèces chimiques.
Ainsi, une écriture du type:
H3O+ + Cl- + Na+
+ HO-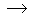 Na+
+2 H2O + Cl-
Na+
+2 H2O + Cl-
sans être fausse est, à tout le moins,
bien
maladroite. Elle est à éviter.
Si dans une équation chimique on ne veut
retenir
que les espèces qui sont réagissantes et omettre les
espèces
spectatrices , on peut bien entendu le faire et l' équation
précédente
se résume à:
H3O+ + + HO-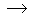 +2
H2O
+2
H2O
Il faut juste avoir un peu plus l' habitude et surtout
bien
tenir présent en tête que la matière est
électriquement
neutre et qu' il ne saurait y avoir de bouteille contenant seulement
des
anions ou de bouteille contenant seulement des cations.
Retour plan du cours de
méthodologie.
Questions
de cours de niveau classe de Seconde.
Retour au plan du cours de
méthodologie.
1. Donner les caractéristiques des principaux
constituants
de l'atome, à savoir les masses et charges respectives du
proton,
du neutron, de l'électron.
2. Que signifie le symbolisme AZX?
3. Qu'est-ce qu' un élément chimique?
Donner
une définition faisant appel au numéro atomique.
4. Les isotopes. Donner des exemples
célèbres.
Qui a découvert la notion d'isotopie? Je signale qu'il se
prénommait "Fred" et que ce Fred là a été
Prix
NOBEL
de Chimie.
5. Qu'est ce que l'unité de masse atomique,
alias
"u.m.a"?
6. Donner le nom et le symbole des 20
premiers éléments chimiques en utilisant les phrases
mnémotechniques suivantes: " Lili berça
bébé
chez notre oncle Ferdinand Nestor." " Napoléon mangea
allègrement
six poulets sans claquer d'argent."
7. Préciser la structure à
l'état
fondamental des atomes de ces 20 premiers éléments en
utilisant
les couches K, L, M, N, O, P.
On rappellera le nombre d'électrons maximal
admissible
que peut contenir une couche de nombre quantique n
donné,
n
étant un nombre entier non nul. Il y a un carré
dans
la réponse....
8. Où se situent les métaux
alcalins
dans
la classification périodique des éléments? Les alcalino-terreux?
Les "chalcogènes", terme malgré tout peu
utilisé
en français? Les halogènes? Les gaz rares?
Donner leur nom et leur symbole chimiqueà
chaque fois.
Citer pour chacune de ces familles deux ou
trois,voire
quatre
exemples.
9. Quel (s) ion(s) monoatomique(s) simple (s)
peut-on
fabriquer à partir du lithium? du magnésium?
de l'aluminium? de l'oxygène? du soufre?
du
chlore?
du calcium? du potassium?
10. Donner la formule des ions suivants: fluorure,
bromure,
iodure, oxyde, sulfure, sulfate, sulfite, thiosulfate,
tétrathionate,
peroxodisulfate (alias persulfate), nitrate, nitrite, hypochlorite,
chlorite,
chlorate, perchlorate, hypobromite, bromite, bromate, perbromate,
hypoiodite,
iodite, iodate, periodate, phosphate.....
Un coup de barre? On respire un petit
coup.....
Mars
et ça repart!!!!!
(mono)hydrogénophosphate,
dihydrogénophosphate,
hydrogénocarbonate (alias bicarbonate), carbonate,
hydrogénosulfure,
hydrogénosulfite, hydrogénosulfate, manganate,
permanganate,
chromate, dichromate, chromite.
Ouf, y en a plus, y en a encore......
11. Quelle est la formule de l'anion
tripolyphosphate?
de l'anion pyrophosphate? de l'anion métabisulfite?
On considèrera pour répondre qu'on a
affaire
à des "anhydrides" minéraux,
résultant
de la condensation de deux groupements acides avec élimination
d'une
molécule d'eau à chaque fois.
On se rappellera la notion d'anhydride avec
l'exemple
en chimie organique de l'anhydride "éthanoïque"
qu'on
fabrique à partir de l'acide éthanoïque.
12. Comment reconnaître les ions suivants: Na+,
Fe2+, Fe3+, Cu2+, Al3+, Zn2+,
Cl-,
SO4 2-, PO43-,
NO3-.
Le test à la soude je veux bien, mais si vous
en connaissez d'autres, c'est mieux. Quoique la soude ça marche
bien pour certains.....
13. Il existe les isotopes 35 et 37
du chlore dans les proportions relatives moyennes de 75% et
de 25%, dans le chlore naturel.
Lorsqu'on dit que la masse molaire de
l'élément
chlore est 35.45 (ou 35.5) g.mol-1, est-ce
qu'il
y a une erreur ?
A t-on voulu dire en fait 35? ou 37? ou
est-ce bien la bonne réponse. Si oui justifier cette valeur....
14. Est-ce qu'un noyau de chlore 35 a une
masse
égale à la somme de 17 fois la masse d'un proton
et de 18 fois celle d'un neutron?
Il y a deux niveaux de réponse possibles. Le
niveau
le plus élevé fait appel à ce qu'a
découvert
et annoncé EINSTEIN en 1905, dans ce qu'il a
appelé
"défaut de masse". Qu'est-ce alors que ce "défaut
de masse"?
Exercices de niveau
classe
de Seconde.
Exercice 1:
On mélange 5 g de limaille de fer avec 11 g de
soufre. On met le feu.
1. Ecrire l'équation chimique sachant qu'il se
forme du sulfure de fer (II).
2. Quelle est la masse de sulfure de fer (II) obtenue?
3. Que reste t-il après réaction qui n'a
pas réagi?
Exercice 2:
On mélange 4 g de poudre d'aluminium avec 6 g
de soufre.
1. Quelle masse de trisulfure de dialuminum , ou plus
simplement de "sulfure d'aluminium" obtient-on ?
2. Que reste t-il après réaction qui n'a
pas été consommé?
Exercice 3:
On obtient 30 g de trioxyde de dialuminium, alias
alumine
ou "oxyde d'aluminium" en traitant de la poudre d'aluminium par un
excès
de dioxygène gazeux.
1. Quelle masse d'aluminium a t-onn utilisé au
départ?
2. Quel volume de dioxygène a t-on dû
utiliser
au minimum , sachant que le volume molaire mesuré dans les
conditions
de l'expérience est de 24 L?
Exercice 4:
Quelle masse de chlorure de potassium (sel anhydre)
faut-il
peser pour préparer 300 mL d'une solution à 0.1 mol.L-1
en ion potassium?
Exercice 5:
On dispose d'une solution de nitrate de cuivre
(II)
qui est à 0.2 mol.L-1 en ion nitrate.
1. Quelle masse de substance a t-il fallu peser pour
obtenir 750 mL de solution?
Pour répondre on précise que le nitrate
de cuivre (II) cristallise avec trois molécules d'eau. C'est un
sel trihydraté.
Exercice 6:
On mélange 1 L d'une solution de chlorure de
sodium
à 15 g.L-1 avec 1 L d'une solution de chlorure
de calcium à 0.01 mol.L-1. Il n'y a pas de
réaction
de précipitation ni de complexation, juste un mélange des
divers constituants.
1. Quelle est la valeur de la concentration,
exprimée
en g.L-1, en mg.L-1et en mol.L-1, en
ion
chlorure?
Exercice 7:
On dissout 4 g de cristaux de soude dans 3 L
d'eau.
On mélange cette solution avec 250 mL d'une solution de chlorure
de cuivre (II) à 0.1 mol.L-1.
1. Quelle masse de précipité obtient-on?
2. Quelle est la concentration des ions restant en
solution?
Exercice 8:
On obtient 500 mg d'un précipité blanc
qui noircit à la lumière lorsqu'on traite 1L d'eau
de mer diluée 10 fois (1L d'eau de mer avec 9 L d'eau
distillée)
par une solution de nitrate d'argent à 0.1 mol.L-1,
utilisée
en excès.
1. Quelle était la concentration,
exprimée
en mol.L-1, en mg.L-1, en g.L-1en ion
chlorure dans l'eau de mer?
Exercice 9:
On mélange 1 L d'une solution de soude à
0.1 mol.L-1 avec 10 L d'une solution d'hydroxyde de sodium
à
3.15 g.L-1.
1. Quel est le pH de la solution obtenue?
Questions
de cours de niveau Première S.
Retour au plan du cours de
méthodologie.
1. Définition d'une oxydation. Il y a
trois
définitions à savoir.
2. Définition d'une réduction.
3. Définition d'un oxydant. Exemples.
4. Définition d'un réducteur.
Exemples.
5. Qu'est-ce qu'une demi-équation
rédox?
Exemples.
6. Définition d'un couple redox.
Exemples.
7. Définition d'un nombre d'oxydation.
Exemples.
8. La règle mnémotechnique
dite du
"gamma". Comment l'utiliser?
9. Quelle est la valeur, à 25 °C, du
potentiel
standard du couple ion hydronium (alias "oxonium")/dihydrogène?
10. Quelle est la réaction chimique qui se
produit
lorsqu'on mélange de la limaille de fer avec de l'acide
chlorhydrique?
On répondra en utilisant l'échelle des
potentiels
standards et on écrira les demi-équations
électroniques
qui interviennent, ainsi que l'équation bilan.
On fera bien apparaître les ions, spectateurs ou
pas, les esèces moléculaires présents dans le
milieu.
11. On mélange de l'acide sulfurique
dilué
et froid avec de la poudre d'aluminium.
Mêmes questions qu'en 10. On considèrera
l'acide sulfurique comme un diacide fort, donc totalement
dissocié
en ions hydronium et sulfate.
12. On remplace l' aluminium par le cuivre.
Mêmes questions qu'en 11. Attention!!!!!
Là
il y a un "piège"!
13. On place une lame de cuivre bien
décapée
dans une solution de nitrate d'argent.
Que se passe t-il?
14. Comment réaliser l'électrolyse
de
l'eau en courant continu?
Qu'obtient-on aux deux électrodes?
Evoquer le phénomène possible de "surtension".
15. Comment réaliser l'électrolyse
de
l'eau en courant alternatif?
Qu'obtient-on aux deux électrodes?
16. Qu'est ce qu'une électrolyse à
anode
soluble? Exemples.Utilité.
17. Comment réaliser un dépot d'or sur
une
plaque métallique de plomb, afin de réaliser du
"plaqué
or", à partir d'une électrolyse adéquate et de
chlorure
d'or (III)?
18. Que donne l'électrolyse du chlorure de
sodium
fondu, en présence de cryolithe?
19. Que donne , en courant continu,
l'électrolyse
d'une solution aqueuse de chlorure de sodium?
Evoquer le rôle possible de certaines "surtensions"
pour expliquer que le dichlore Cl2 se dégage
à
l'anode avant le dioxygène O2.
20. Faire le schéma d'une pile DANIELL,
utilisant les deux couples redox Zn(II)/Zn et Cu(II)/Cu.
Préciser:
-l'anode,
-la cathode,
-le sens conventionnel du courant,
-le sens de déplacement des électrons une
fois que la pile débite,
-l'électrode siège de la réduction,
-l'électrode siège de l'oxydation,
-le pôle positif,
-le pôle négatif.
Exercices de niveau
classe
de Première S.
Exercice 1:
On plonge une lame d'aluminium de masse égale
à 5g dans 10 L d'une solution d'acide chlorhydrique à
0.01
mol.L-1.
1. Quelle est la concentration, exprimée en mol.L-1,
des ions aluminium après réaction complète de
l'aluminium?
Exercice 2:
1. Quel volume de dihydrogène (volume molaire
mesué dans les conditions de l'expérience égal
à
24 L) peut-on obtenir lorsqu'on traite 38 g de zinc par 5 L d'acide
sulfurique
à 0.05 mol.L-1?
2. Quelle est la concentration des ions zinc
après
réaction?
Exercice 3:
1. Ecrire la réaction entre le diiode I2
et les ions thiosulfate S2O32-.
2. On verse 50mL d'une solution de thiosulfate de
sodium
à 0.1 mol.L-1dans 150mL d'une solution de
diiode
de concentration inconnue( préparée dans de l'iodure de
potassium,
afin de solubiliser dans l'eau, composé polaire, le
diiode,
composé peu polaire: il se forme alors du triiodure de
potassium
KI3). Le virage a lieu lorsqu'on a versé les 50mL de
thiosulfate.
Quelle est la concentration en diiode dans la solution?
Exercice 4:
On traite une solution de sulfate de fer (II),
acidifiée par de l'acide sulfurique, par une solution de
permanganate
de potassium de concentration 0.02 mol.L-1. Le volume de la
solution de fer (II) est de 50 mL. Le volume équivalent est de
18.6
mL.
1. Quelle est la concentration des ions fer(II) dans
la solution?
2. Pourquoi la couleur à l'équivalence
présente t-elle une couleur transitoire: au lieu de rester
violette
la solution prend assez vite une couleur marron?
Question très difficile j'en conviens.
Penser à une réaction
d'amphotérisation,
je n'en dis pas plus, entre les ions permanganate, les ions
manganèse
(II) et le dioxyde de manganèse MnO2.
Exercice 5:
1. Ecrire l'équation chimique complète
de l'oxydation de la molécule d'éthanol en acide
éthanoïque
par le dichromate de potassium en miluieu acide.
2. On traite 50 mL d'une solution hydroalcoolique par
18 mL d'une solution de dichromate de potassium à 0.03 mol.L-1.
Quelle est la concentration, exprimée en mol.L-1,
en éthanol de la solution?
Exercice 6:
On traite une solution aqueuse de
méthanal,
alias formol, de formule CH2O, de volume 50 mL, par une
solution
de permanganate de potassium de concentration 0.05 mol.L-1,
acidifiée par l'acide sulfurique.
Le virage se produit lorsqu'on a versé 7.35 mL
de solution de permanganate de potassium.
1. Quelle est la concentration, exprimée en mol.L-1,
en g.L-1,de la solution de méthanal?
Exercice 7:
Donner le nombre d'oxydation de chacun des
éléments
entrant dans la composition des espèces suivantes:
Na, Na+, Ca2+, fluorure, oxyde,
peroxyde, hyperoxyde (alias superoxyde O2-),
hydroperoxyde,
hydroxyde, hydronium (alias oxonium), eau, dioxygène,
trioxygène
(alias ozone)...
dioxyde de soufre, trioxyde de soufre, sulfate,
sulfite,
hydrogénosulfite, chlorure, hypochlorite, chlorite, chlorate,
perchlorate,
iodure, hypoiodure, iodite, iodate, periodate, difluorure
d'oxygène,
dichromate, permanganate, manganate, oxyde de manganèse (II),
dioxyde
de manganèse (IV), Mn2+, Fe2+, Fe3+,
Cu+, Cu2+.
Exercice 8:
1. La réaction entre les ions hydronium et les
ions hydroxyde est-elle une réaction redox? Si oui dites
pourquoi,
si non dites pourquoi.
Exercice 9:
1. Dire si la réaction suivante, que l'on aura
au préalable équilibrée, est redox ou pas:
H2SO4 + C 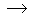 CO2 + SO2 + H2O
CO2 + SO2 + H2O
Exercice 10:
On traite 100 mL d'une solution aqueuse de glucose,
un aldohexose de formule C6H12O6,
HOCH2(CHOH)4CHO
, par la liqueur de FEHLING, un mélange de sel de SEIGNETTE
(alias tartrate double de sodium et de potassium,
Na+ -O2C(CHOH)2CO2-
K+),
de sulfate de cuivre (II) et de soude.
On obtient, après chauffage du
mélange,
du
gluconate de sodium et de potassium (anion gluconate de
formule
HOCH2(CHOH)4CO2-
) et de l'oxyde de cuivre (I), qui est solide et de
couleur
rouge
brique.
1. La masse de Cu2O obtenue est
de 500
mg. Quelle est la masse de glucose présente dans
l'échantillon
de départ?
Attention!!! Il faut ici équilibrer
une
réaction
redox en milieu basique. Il faut tout d'abord équilibrer
chaque
couple avec des ions hydronium puis, ensuite, rajouter autant d'ions
hydroxyde
que nécessaire , de part et d'autre des membres de
l'équation,
pour faire apparaître des molécules d'eau et ne plus
laisser
que des ions hydroxyde.
Questions
de cours de niveau Terminale S.
Retour au plan du cours de
méthodologie.
1. Donner la formule générale des alcanes.
Citer les quinze premiers alcanes.
2. Donner la formule générale des alcènes.
Exemples d'alcènes, à l'état gazeux et à
l'état
liquide.
3. Qu'est-ce que la nomenclature Z-E?
Exemples.
4. Donner la formule générale des alcynes.
Exemples.
5. Quelle est la formule brute et
développée
du benzène?
Qui l'a proposée pour la première
fois?
Quand? Voir du côté de l'Allemagne ...
6. Qu'est-ce que le toluène?
7. Qu'est-ce qu'un alcool, au sens chimique
du
mot? Exemples (pas le Ricard!!!!).
8. Qu'est-ce qu'un aldéhyde? Exemples.
9. Qu'est-ce qu'une cétone? Exemples.
10. Qu'est-ce qu'un acide carboxylique?
Exemples.
11. Qu'est-ce qu'un ester? Exemples.
Qui a étudié la réaction
d'estérification
le
premier? Quand? Voir du côté de la France....
12. Qu'est-ce qu'un éther-oxyde?
Exemples.
13. Qu'est-ce qu'un chlorure d'acide ou chlorure
d'acyle? Exemples. Utilisation?
14. Qu'est-ce qu'un anhydride d'acide?
Exemples.
Utilisation?
15. Qu'est ce qu'un polymère?
Citer un exemple parmi les polymères de polyaddition
et
un autre parmi les polymères de polycondensation.
On précisera les notions de monomère,
d'homopolymère, de copolymère, de motif,
de degré de polymérisation.
Au fait, qui était Wallace CAROTHERS?
16. Une macromolécule, qu'est-ce que
c'est?
Donner deux exemples issus du monde naturel.
17. Un triglycéride qu'est-ce que
c'est?
Exemples. Dire à partir de quels types de composés
chimiques on peut le former.
18. La saponification des triglycérides
conduit à la formation de quels composés? Quelle est leur
utilité?
19. Une micelle, qu'est-ce que c'est?
Préciser
son mode d'action.
20. Qu'est-ce qu'un carbone asymétrique?
Qui
en a parlé pour la première fois? Voir du
côté
de la Hollande. Non, ce n'est pas van der WAALS!!!!
21. Quelle propriété physique est
liée
à la présence d'un carbone asymétrique dans une
molécule
dite "chirale"?
22. Est-ce que le méthane est optiquement
actif?
23. Est-ce que l'acide lactique, alias acide
2
hydroxy propanoïque est chiral? Si oui
représenter
dans l'espace, avec la projection dite de CRAM, les deux
énantiomères
(stéréoisomères) de cet acide.
24. Qu'est ce qu'un acide aminé?
Donner
sa formule générale. Le représenter dans la
projection
de
CRAM.
Exercices de niveau
Terminale
S.
Exercice 1:
Le saccharose (alias sucre en poudre) a
pour formule brute C12H22O11.
1. Quelle est la composition centésimale
massique en carbone, hydrogène et oxygène?
Exercice 2:
On désire obtenir de l'éthanoate de 3
méthyl
butyle (alias acétate d'isoamyle, à odeur de banane).
1. On part d'acide éthanoïque et d'un
alcool,
mélangés tous deux en proportions
stoechiométriques.
Quel est cet alcool?
2. Qu'obtient-on au bout d'un temps très long?
3. Que vaut alors le rendement réactionnel?
4. Comment s'appelle la réaction inverse?
Quelles
sont ses caractéristiques?
Exercice 3:
On traite le propanoate de pentyle par la potasse.
1. Qu'obtient-on? Caractéristiques de la
réaction?
2. Quelle masse de potasse a t-il fallu utiliser pour
traiter 31.5 moles de l'ester précédent?
3. L'alcool obtenu peut-il être oxydé par
une solution diluée de permanganate de potassium,
acidifiée
par de l'acide sulfurique?
4. Si oui à la question précédente
indiquerla formule, le nom de l'acide obtenu par oxydation. Ecrire les
équations chimiques correspondantes.
Exercice 4:
1. Quelle masse de chlorure d'éthanoyle doit-on
utiliser pour obtenir 13.75 g d'éthanoate de 3 méthyl
butyle?
On admet que la réaction d'obtention de l'ester a un rendement
de
100%.
2. Quelle précaution doit-on prendre avec le
chlorure
d'éthanoyle?
Formulaires
Retour au plan du cours de
méthodologie.
Annexe 1: masses
molaires
des éléments chimiques les plus usuels:
Les valeurs sont exprimées en g.mol-1.
Les numéros atomiques Z sont
donnés
après le symbole chimique de l'élément.
Elément chimique
Symbole
|
Numéro
atomique Z |
Masse
atomique |
| Hydrogène, H |
1
|
1.008
|
| Lithium, Li |
3
|
6.94
|
| Bore, B |
5
|
10.81
|
| Carbone, C |
6
|
12.01
|
| Azote, N |
7
|
14.01
|
| Oxygène, O |
8
|
16.00
|
| Fluor, F |
9
|
19.00
|
| Sodium, Na |
11
|
22.99
|
|
Magnésium, Mg
|
12
|
24.31
|
| Aluminium, Al |
13
|
26.98
|
| Silicium, Si |
14
|
28.09
|
| Phosphore, P |
15
|
30.97
|
| Soufre, S |
16
|
32.07
|
| Chlore, Cl |
17
|
35.45
|
| Potassium, K |
19
|
39.10
|
| Calcium, Ca |
20
|
40.08
|
| Chrome, Cr |
24
|
52.00
|
| Fer, Fe |
26
|
55.85
|
| Cuivre, Cu |
29
|
63.55
|
| Zinc, Zn |
30
|
65.4
|
| Brome, Br |
35
|
79.90
|
| Argent, Ag |
47
|
107.9
|
| Iode, I |
53
|
126.9
|
| Baryum, Ba |
56
|
137.3
|
| Or, Au |
79
|
197.0
|
| Mercure, Hg |
80
|
200.6
|
| Uranium, U |
92
|
238.0
|
Annexe 2: potentiels
standard
d'oxydoréduction usuels, à 25°C.
| Couple redox |
potentiel |
Commentaires |
Couple |
potentiel |
commentaires |
| F2/ F - |
2.87 V |
|
H3O+/H2 |
PAR
DEFINITION
0.00 V |
Réduction de l'eau. |
| S2O82-/ SO42- |
2.01 V |
|
Fe2+/ Fe |
-0.44 V |
|
| H2O2/ H2O |
1.77 V |
|
CO2 / H2C2O4 |
-0.49V |
|
| MnO4-/ Mn2+ |
1.51 V |
|
Zn2+ / Zn |
-0.76 V |
|
| Cl2 / Cl- |
1.40 V |
|
Al3+ / Al |
-1.68 V |
|
| Cr2O72-/ Cr3+ |
1.33 V |
|
Na+ / Na |
-2.71 V |
|
| MnO2/ Mn2+ |
1.23 V |
|
|
|
|
| O2 / H2O |
1.23V |
Oxydation de l'eau. |
|
|
|
| Ag+ / Ag |
0.80 V |
|
|
|
|
| Fe3+/ Fe2+ |
0.77V |
|
|
|
|
| O2/ H2O2 |
0.68 V |
|
|
|
|
| I2/ I- |
0.62 V |
|
|
|
|
| Cu2+/ Cu |
0.34 V |
|
|
|
|
| SO42-/ SO2 |
0.20 V |
|
|
|
|
| CH3CHO / CH3CH2OH |
0.19 V |
|
|
|
|
| CH3CO2H / CH3CHO |
0.12 V |
|
|
|
|
| S4O62-/ S2O32- |
0.09 V |
|
|
|
|
| CH3CO2H / CH3CH2OH |
0.05 V |
|
|
|
|
|
|
|
|
|
|
Fin provisoire. The end. Fund. Fin. Final. Koniek.
Kaniets.
![]() (grec),
bun
venit (roumain), hoz geldiniz (turc),
(grec),
bun
venit (roumain), hoz geldiniz (turc),![]() dobro pojalovat (russe), dzien dobrey (polonais), bud'
te vitany (tchèque), huan ying (chinois), failte
(gaélique), rlde
shalom
(hébreu) , bonvenon (espéranto) , etc....
sur
la page Web de méthodologie CHIMIE que je viens de
créer
à votre intention.
dobro pojalovat (russe), dzien dobrey (polonais), bud'
te vitany (tchèque), huan ying (chinois), failte
(gaélique), rlde
shalom
(hébreu) , bonvenon (espéranto) , etc....
sur
la page Web de méthodologie CHIMIE que je viens de
créer
à votre intention.
![]()
![]() Da zvidania....
Da zvidania....