(NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2H)2
+ M2+![]() (
NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2)2M
+ 2H+
(
NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2)2M
+ 2H+
I. Complexométrie.
L' acide éthylène diamine tétraacétique, symbolisé par le sigle EDTA, donne, avec pratiquement tous les cations métalliques de valence deux, trois ou quatre, des chélates (du grec cele, c' est à dire "pince"), grâce notamment aux deux doublets non liants présents sur chacun des atomes d' azote de la molécule d' EDTA.
On utilise souvent le sel disodique de l' EDTA, noté Na2YH2.
(NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2H)2
+ M2+![]() (
NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2)2M
+ 2H+
(
NaO2C-CH2)2-N-CH2-CH2-N-(CH2-CO2)2M
+ 2H+
Ce qu' on symbolisera par:
H2Y2- + M2+![]() MY2-
+ 2H+
MY2-
+ 2H+
Cette propriété va permettre de doser de
très nombreux cations.
La stabilité du complexe formé entre le
cation et l' EDTA sera fonction du pH du mileu.
Le rôle des milieux tampons sera ainsi fortement
mis en évidence, les réactions se faisant alors de façon
convenable à un pH donné.
Il est très commode, dans la pratique, d' employer
des indicateurs colorés pour déceler le point d' équivalence.
Souvent on utilise le NET, alias noir ériochrome
T, qui est un colorant diazoïque (voir cours de chimie sur les amines),
ou bien le murexide et, pour des déterminations spécifiques
comme celle du calcium, le réactif de PATTON et REEDER.
II. Manipulations.
1. Etalonnage d' une solution d' EDTA par une solution
titrée de zinc (II), Zn2+.
L' EDTA étant pratiquement insoluble dans l' eau, la concentration maximale de cet agent complexant sera voisine de 0.01 mol.L-1 au maximum.
Prendre une prise d' essai de 10 mL de la solution titrée
de zinc (II).
Rajouter 10 mL de solution tampon pH 9.25, confectionnée
avec de l' ammoniaque et du chlorure d' ammonium.
Rajouter une pincée de NET.
Verser l' EDTA contenu dans la burette jusqu' au changement
de couleur de l' indicateur coloré.
En déduire la concentration C EDTA
de la solution d' EDTA.
2. Dosage d' un mélange d' ions zinc (II) et magnésium (II), Zn2+ et Mg2+.
2.a. Dosage de la somme Zn (II) + Mg (II).
Même protocole que précédemment, sauf qu' on remplace les 10 mL de solution titrée de Zn (II) par 10 mL du mélange Zn (II) Mg (II).
2.b. Complexation des ions Mg (II) par ajout de flourure d' ammonium solide.
Même protocole que précédemment.
En déduire la concentration en ions Zn (II) et
celle en ions Mg (II) contenus dans le mélange.
3. Dosage de la dureté d' une eau du robinet.
Prise d' essai d' eau du robinet: 10 mL. Même protocole
que d' habitude. Les ions Ca (II) se complexent en premier Puis, lorsque
tout le calcium est complexé les ions Mg (II) réagissent.
En fin de réaction la couleur bleue apparaît.
Détermination de la concentration globale Ca (II)
+ Mg (II) de l' eau minérale.
Détermination de son degré hydrotimétrique.
Définition du degré hydrotimétrique,
ou titre hydrotimétrique, ou degré français,
noté TH ou ou °f, d' une eau.
Une eau a un TH de X si elle contient X.10-4
mol d' ions Ca2+ et/ou Mg2+, comptés ensemble,
par litre d' eau. Une eau sera dite "dure" si son TH dépasse la
valeur de 25.
Un degré français de 1 pour une eau signifie qu' elle contient l' équivalent en moles de calcium et/ou de magnésium qu' une eau contenant 10 mg de carbonate de calcium par litre d' eau. Or 10 mg de CaCO3 équivalent à 10-4 mol de CaCO3.
Il y a d' autres définitions où la référence est, non pas le carbonate de calcium CaCO3 mais l' oxyde de calcium CaO.
4. Vérification de la composition en calcium et
en magnésium de différentes eaux minérales du commerce.
Les étiquettes collées sur les bouteilles
indiquent la minéralité de ces eaux.
Choisir par exemple deux cas de minéralités
extrêmes: Hépar, eau très dure, et Volvic, eau très
peu minéralisée.
Comparer leur degré hydrotimétrique expérimental
et leur degré hydrotimétrique théorique, calculé
d' après les données écrites surles bouteilles.
5. Dosage sélectif du calcium (II) en présence du réaction de PATTON et REEDER.
Prendre 10 mL d' eau minérale.
Rajouter 2 mL de soude à 0.1 mol.L-1.
Rajouter une pincée de réactif de PATTON et REEDER.
Le virage de l' indicateur coloré se fait du violet
au bleu.
Donner la concentration en calcium (II) et en magnésium
(II) de l' eau minérale analysée.
Comparer avec les inscriptions sur l' étiquette.
Retour sommaire des TP de chimie générale.
Retour au sommaire des TP de chimie générale.
I. Introduction.
L' oxydoréduction est un échange électronique entre deux espèces:
a Ox + n é ![]() b
Red
b
Red
E = E° + ![]() ln
ln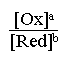
A 298 K, et en remplaçant les constantes par leurs valeurs numériques, l' expression s' écrit en utilisant le logarithme décimal, log:
E = E° + 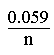 log
log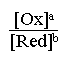
De nombreuses réactions d' oxydoréduction font, en plus de l' échange d' électrons entre les formes Ox et Red, intervenir des protons.
Il en résulte que les propriétés
oxydoréductrices dépendent du pH ou, inversement, qu' une
réaction d' oxydoréduction modifie le pH.
Le schéma d' écriture général
de la réaction devient alors:
a Ox + m H3O+ + n é ![]() b
Red + c H2O
b
Red + c H2O
Il lui correspond un potentiel d' équilibre E tel que:
E = E° + 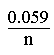 log
log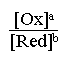 - 0.059.
- 0.059.![]() . pH
. pH
Les mesures qui seront faites par l' étudiant seront des mesures de différence de potentiel DE entre deux électrodes, puisqu' on ne lit jamais un potentiel mais une différence de potentiel entre deux électrodes: l' électrode de mesure, en général en platine, qui mesurera E et l' électrode de référence, en général une électrode au calomel, saturée en KCl, et dont le potentiel E° par rapport à l' électrode normale à hydrogène vaut 0.24 V. Ce potentiel restera fixe tout au long de la mesure.
Ainsi, pour exprimer le potentiel de mesure E mesure , pris par l' électrode de platine, on aura la relation suivante:
E mesure = DE lu + 240
On se propose de tracer la variation du potentiel de mesure E mesure de chaque équilibre d' un système donné, en fonction du pH de la solution.
Ce tracé est particulièrement intéressant, comme l' a montré l' école belge de Marcel POURBAIX, pour l' étude de la corrosion des métaux en solution aqueuse acidobasique et au contact d' un mileu oxydoréducteur.
II. Tracé des diagrammes de POURBAIX.
Pour un élément donné et une concentration
fixée de l' élément en solution , on représente
par des droites, ou "frontières" , les variations du potentiel E
mesure des différents équilibres en fonction du pH.
Dans un système d' axes E mesure -
pH et dans le cas où le rapport 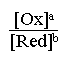 vaut 1, les courbes E mesure = f (pH) sont des droites d' équation:
vaut 1, les courbes E mesure = f (pH) sont des droites d' équation:
Au-dessus des droites il y a prédominance de la
forme oxydée Ox sur la forme réduite Red car E mesure![]() E° implique que [Ox]
E° implique que [Ox] ![]() [Red].
[Red].
Au-dessous des droites il y a prédominance de la
forme réduite Red sur la forme oxydée Ox car E mesure![]() E°
implique que [Ox]
E°
implique que [Ox] ![]() [Red].
[Red].
Si l' équilibre électrochimique est indépendant du pH, comme lorsqu' il se produit l' équilibre:
Mn+ + n é ![]() M
M
alors la droite E mesure = f (pH) est parallèle à l' axe des pH. Son ordonnée à l' origine vaut alors:
L' utilisation de telles représentations graphiques mettant en évidence de façon très visualisée les régions de prédominance des diverses espèces est très utile à la compréhension de la chimie inorganique en solution aqueuse.
III. Etude théorique du diagramme d' équilibre potentiel-pH du fer.
En première approximation on considèrera le système approché comprenant les constituants suivants:
Fe solide; Fe (II); Fe (III); Fe(OH)2solide; Fe(OH)3 solide.
Les diverses droites frontières sont représentées pour les équilibres suivants:
Droite (1):
Fe2+ +2 é ![]() Fe
Fe
La valeur théorique du potentiel normal E° du couple redox Fe2+/Fe est - 0.44 V.
Droite (2):
Fe3+ + é ![]() Fe2+
Fe2+
La valeur théorique du potentiel normal du couple
redox Fe3+/Fe2+ est égale à 0.77
V.
En mileu sulfurique, du fait de la complexation des ions
Fe(II) et Fe (III) avec les anions sulfate, la valeur expérimentale
de E° devient 0.68 V.
Droite (3):
Fe2+ + 2 HO- ![]() Fe(OH)2
solide
Fe(OH)2
solide
La valeur du produit de solubilité Ks de l' hydroxyde de fer (II), Fe(OH)2 est égale à 1,64.10-14.
Droite (4):
Fe3+ + 3 HO-![]() Fe(OH)3solide
Fe(OH)3solide
La valeur du produit de solubilité Ks de l' hydroxyde de fer (III), Fe(OH)3, est égale à 1,1.10-36.
Droite (5):
Fe(OH)3 solide + 3 H3O+
+ é ![]() Fe2+
+ 6 H2O
Fe2+
+ 6 H2O
Droite (6):
Fe(OH)2 solide + 2 H3O+ +
2é ![]() Fe
solide
+ 4 H2O
Fe
solide
+ 4 H2O
Droite (7):
Fe(OH)3 solide + H3O+
+ é ![]() Fe(OH)2
solide + 2 H2O.
Fe(OH)2
solide + 2 H2O.
IV.Etude expérimentale des équilibres (2), (5) et (7).
Pour effectuer le travail on dispose de trois électrodes: une électrode de mesure, en platine; une électrode de référence au calomel, saturée en KCl, et une électrode combinée de pH.
On pourra ainsi, simultanément, mesurer la différence de potentiel DE entre les électrodes de mesure et de référence et le pH de la solution.
Dans cette étude les électrodes plongeront dans une solution contenant les ions Fe (II) et Fe (III) dont le pH initial sera 0.
IV.1. Préparation des solutions de Fe (II) et de Fe (III).
IV.1.1. Solution de Fe (II).
A l' aide de cristaux de sel de MOHR (sulfate double de fer (II) et d' ammonium, hexahydraté: Fe(NH4)2(SO4)2,6H2O) préparer 200 mL d' une solution à 0.05 mol.L-1 en Fe (II). La masse molaire du sel de MOHR est égale à 392 g.mol-1. On dissoudra les cristaux dans 1 mL d' acide perchlorique concentré HClO4. On étendra la solution à 200 mL avec de l' eau distillée.
IV.1.2. Solution de Fe (III).
Préparer un volume de 200 mL d' une solution à 0.05 mol.L-1 en Fe (III) à partir de sulfate de fer (III).
IV.2. Tracé des droites correspondant aux équilibres (2), (5) et (7).
Dans un bécher de 250 mL mélanger 50 mL
de chacune des deux solutions préparées en IV.1.
Plonger les électrodes de travail.
Verser goutte à goutte la soude à 3 mol.L-1.
Après chaque addition de soude noter les valeurs du pH et de la différence de potentiel DE lu.
Utiliser la soude à 3 mol.L-1 jusqu' à pH 9 puis ensuite la soude à 10 mol.L-1.
Entre chaque addition de soude ne pas oublier d' agiter la solution. Attendre toujours que l' équilibre soit réalisé: pH et différence de potentiel DE stables.
Noter chaque couple de valeurs (DE ; pH).
En déduire chaque couple (E mesure ; pH).
Tracer les droites obtenues expérimentalement sur une feuille de papier millimétré.
IV.3. Exploitation des résultats.
Donner les valeurs des pH correspondant aux deux points d' intersection des droites.
Les lignes frontières entre Fe (II) et Fe(OH)2 solide, ainsi que celles entre Fe (III) et Fe (OH)3 solide sont des verticales. Les tracer et en déduire les domaines de stabilité de Fe (II), de Fe (III), de Fe(OH)2 solide, ainsi que de Fe(OH)3 solide.
IV.4. Etude théorique des équilibres (3) et (4).
IV.4.1. Equilibre (3).
Exprimer la valeur du pH en fonction de la concentration
des ions Fe (II), connaissant la valeur du produit de solubilité
de Fe(OH)2 solide, à savoir Ks = 1,64.10-16
à 25°C.
On rappelle que le produit ionique de l' eau, Ke,
Ke = (H3O+)(HO-) , vaut
10-14 à la même température.
Donner la valeur du pH de début de précipitation
de Fe(OH)2 solide pour une concentration en Fe(II) égale
à 0.025 mol.L-1.
Comparer cette valeur à celle obtenue expérimentalement.
IV.4.2. Equilibre (4).
Mêmes questions qu' en IV.4.1. mais cette fois pour l' équilibre (4). Le produit de solubilité Ks de l' hydroxyde de fer (III) Fe(OH)3 solide est égal à Ks = 1,1.10-36 à 25°C.
IV.5. Etude théorique des équilibres (1) et (6).
En appliquant la formule de NERNST donner l' expression
du potentiel E 1 correspondant à l' équilibre
(1) en fonction de la concentration en Fe (II), sachant que le potentiel
E° du couple Fe2+/Fe est égal à -0.44 V.
En déduire la valeur de E 1 lorsque
la concentration en Fe (II) est égale à 0.025 mol.L-1.
Tracer la ligne frontière relative à l'
équilibre (1) et en déduire les coordonnées du point
de concours A avec la droite correspondant à l' équilibre
(6).
A l' aide de l' équation de NERNST appliquée à la réaction (6) et des coordonnées du point A, donner l' expression du potentiel E 6 de l' équilibre (6) en fonction du pH et le tracer sur le diagramme.
IV.6. Interprétation du diagramme.
En utilisant les résultats précédents, préciser les dommaines d' existence des différents constittuants du système fer-eau.
Tracer sur le même diagramme les deux droites correspondant
respectivement à l' oxydation de l' eau et à la réduction
de l' eau.
On considèrera que la pression des gaz est égale
à 1 bar.
Pour l' oxydation de l' eau le potentiel normal E°
du couple redox mis en jeu, O2/H2O, est
égal à 1.23 V.
Pour la réduction de l' eau le potentiel normal
E° du couple redox mis en jeu, H3O+/H2
, est égal à 0.00 V.
En déduire le caractère métastable
(thermodynamiquement instable mais cinétiquement "favorisé",
c' est à dire avec une décomposition à la vitesse
extrêmement lente) dans l' eau des espèces suivantes: Fe solide,
Fe (II), Fe(OH)2 solide.
En déduire le caractère thermodynamiquement
stable des espèces suivantes: Fe (III) et Fe(OH)3 solide.
Pour les plus courageux:
Indiquer comment sont modifiées les lignes frontières
lorsque la concentration en fer devient égale à 1 mol.L-1
(cas d' école).