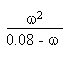
Retour au plan du cours sur les pH des solutions aqueuses.
Exercice IV.10.
1. La courbe de pH se découpera en trois parties.
Première partie: de V = 0 à V = 40 mL,
soit de V/Ve = 0 à V/Ve = 1.
Le pH initial est donné par la formule:
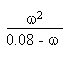


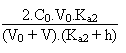
Deuxième partie: entre V = 40 et V = 80 mL, soit
entre V/Ve =1 et V/Ve = 2.
Lorsque le volume V sera égal à 80 mL on
se retouvera avec une solution aqueuse d' acide sulfhydrique H2S
de concentration égale à 0.044 mol.L-1, mélangé
à du chlorure de sodium de concentration égale à 0.089
mol.L-1. Le pH sera imposé par l' acide sulhydrique étant
donné que le chlorure de sodium n' influe pas sur le pH de la solution.
On trouve un pH de 4.18.
Entre les deux valeurs il faudra résoudre l' équation
de l'électroneutralité suivante:


Que vaut par exemple le pH de la solution lorsque V est
égal à 73 mL?
On aura à résoudre l' équation de
l' électroneutralité suivante:
Troisième partie: au-delà de V = 80 mL,
soit au-delà de V/Ve = 2.
Le pH de la solution sera imposé par l' excès
d' acide chlorhydrique.
Le pH sera donné par la formule:
1. La courbe de dosage se divisera en trois parties.
Première partie: entre V = 0 et V = 40 mL, soit
entre V/Ve = 0 et V/Ve = 1.
Le pH initial est donné par l' équation
du second degré obtenue à partir de:

Entre les deux valeurs il faudra résoudre l' équation de l' électroneutralité suivante:

Il faudra vérifier que la réaction d' amphotérisation de l' anion hydrogéno-oxalate:
Exemple: que vaut le pH de la solution lorsque V est égal
à 12 mL?
On résout alors l'équation du second degré
suivante:
On trouve un pH de 1.55.
A ce pH on est loin de la zone où la forme oxalate
intervient. la réaction d'amphotérisation est donc négligeable
et n' influera pas sur le pH. On pourra confirmer cela en cours de Thermodynamique
chimique avec l' étude de la loi d' action de masse qui va dans
le sens décrit.
Deuxième partie: entre V = 40 et V = 80 mL, soit
ente V/Ve = 1 et V/Ve = 2.
Lorsque le volume V est égal à 80 mL on
se retrouve avec une solution aqueuse d' oxalate de disodium, plus communément
appelé oxalate de sodium, de concentration égale à
0.044 mol.L-1.
Le pH de la solution sera donné par la formule:

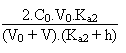
Troisième partie: au-delà de V = 80 mL,
soit au-delà de V/Ve = 2.
La soude en excès impose son pH.
Le pH sera donné par la relation:
3. Il se sera formé 8.10-3 mol d' oxalate de disodium. La masse est de 1.072 g si le sel cristallise sans emprisonner de molécule d' eau dans sa formule.
Exercice IV.12.
1. Le pH initial de la solution est égal à 8.60. La valeur est calculée à partir de la formule:
Lorsque V = 40 mL on est en présence d' une solution
aqueuse d' hydrogéno-oxalate de sodium NaHC2O4 de
concentration égale à 0.057 mol.L-1. Le pH de
la solution est égal à 0,5.(1,2 + 4,3), soit à 2.75.
Lorsque V = 80 mL on est en présence d' une solution
aqueuse contenant du chlorure de sodium à la concentration de 0.089
mol.L-1 et de l' acide oxalique à la concentration de
0.044 mol.L-1. Le pH sera imposé par l' acide oxalique
seul.
Il faudra résoudre l' équation suivante:
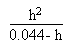
Première partie: entre V/Ve = 0 et V/Ve = 1.
Il faut résoudre l' équation de l' électroneutralité suivante:


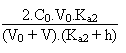
Deuxième partie: entre V/Ve = 1 et V/Ve = 2.
Il faut résoudre l' équation d' électroneutralité suivante:

Troisième partie: au-delà de V/Ve = 2.
Le pH est imposé par l' excès d' acide chlorhydrique.
On aura la relation:
1. La courbe de dosage se découpe en quatre parties.
Première partie: de V = 0 à V = 40 mL, soit de V/Ve = 0 à V/Ve = 1.
Le pH initial est celui d' une solution aqueuse d' acide
phosphorique de concentration égale à 0.08 mol.L-1.
L' acide phosphorique se comportera comme un monoacide faible de pKa égal
à pKa1, soit 2.15.
On résoudra l' équation du second degré
issue de:


Deuxième partie: de V = 40 à V = 80 mL, soit de V/Ve = 1 à V/Ve = 2.
Lorsque V = 80 mL on se retrouve avec une solution aqueuse
d' hydrogénophosphate de disodium Na2HPO4,
de concentration égale à 0.044 mol.L-1. Le pH
sera donné par la formule des hydrogénosels et on aura:
pH = 0,5.(7.20 + 12.10), soit 9.65.
Entre les valeurs de V/Ve = 1 et V/Ve = 2 il faut résoudre
l' équation de l' électroneutralité suivante:

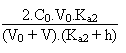
Troisième partie: de V/Ve = 2 à V/Ve = 3.
Lorsque le volume V est égal à 120 mL on
se retrouve avec une solution de phosphate de trisodium Na3PO4
de concentration égale à 0.036 mol.L-1.
Le pH sera donné par la formule du pH d' une polybase
faible se comportant comme une monobase faible de pKb égal
à pKb3 soit 1.90.
Nous aurons:
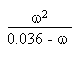

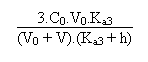
2.57.h2 -2.03.10-12.h - 7.94.10-25 = 0
Quatrième et dernière partie: au-delà de V/Ve = 3.
La soude imposera son pH à la solution.
Le pH sera donné par la relation:
3. Il se sera formé une quantité de phosphate
de trisodium égale à 8.10-3 mol.
La masse de sel qu' on pourra espérer recueillir
sera égale à 1312 mg si le phosphate de trisodium ne cristallise
avec aucune molécule d' eau dans son groupement formulaire.
Exercice IV.14.
1. Le pH initial est celui d' une polybase faible qui
se comporte comme une monobase faible de pKb égal à pKb3,
soit 1.90.
On aura à résoudre une équation
du second degré à partir de:
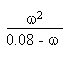

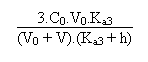
Deuxième partie: entre V/Ve = 1 et V/Ve = 2.
Lorsque le volume d' acide chlorhydrique versé
est égal à 80 mL (V/Ve = 2) on est en présence d'
une solution aqueuse de chlorure de sodium de concentration égale
à 0.089 mol.L-1 et de dihydrogénophosphate de
sodium NaH2PO4 de concentration égale à
0.044 mol.L-1. Ce sera le dihydrogénophosphate de sodium
qui imposera son pH à la solution.
Nous aurons alors le pH d' une solution d' hydrogénosel,
le chlorure de sodium n' intervenant pas dans la valeur du pH de la solution.
Numériquement nous aurons:
pH = 0,5.(7.20 + 2.15), soit pH = 4.68.
Entre les deux valeurs extrêmes il faudra résoudre
l' équation de l' électroneutralité suivante:

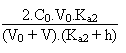
On trouve un pH de 6.35.
Troisième partie: entre V/Ve = 2 et V/Ve = 3.
Lorsque V/ve est égal à 3, soit que V est
égal à 120 mL, on se retrouve avec une solution aqueuse d'
acide phosphorique de concentration égale à 0.036 mol.L-1
mélangé
à du chlorure de sodium à la concentration égale à
0.109 mol.L-1. Le pH sera imposé pa l' acide phosphorique,
polyacide se comportant comme un monoacide faible de pKa égal à
pKa1.
On aura dès lors:
Entre les deux valeurs extrêmes il faudra résoudre l' équation de l' électroneutralité suivante:

Quatrième partie: au-delà de V/Ve = 3, soit au-delà de V = 120 mL.
L' acide chlorhydrique en excès imposera son pH
à la solution.
On aura alors:

Exercice IV.15.
1. La courbe de dosage de l' acide citrique se décomposera en quatre parties.
Première partie: de V/Ve = 0 à V/Ve = 1, soit de V = 0 à V = 40 mL.
La valeur initiale du pH sera donnée par la relation suivante:


Deuxième partie: entre V/Ve =1 et V/Ve = 2, soit entre V = 40 et V = 80 mL.
Lorsque V est égal à 80 mL on est en présence
d' une solution aqueuse d' hydrogénocitrate de disodium Na2HCi
de concentration égale à 0.044 mol.L-1. Le pH
de la solution sera alors égal à 0,5.(4,80 + 6.40), soit
5.60.
Entre les deux valeurs on devra résoudre l' équation
de l' électroneutralité de la solution:

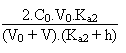
Troisième partie: de V/Ve = 2 à V/Ve = 3, soit de V = 80 à V = 120 mL.
Lorsque V = 120 mL on est en présence d' une solution
aqueuse de citrate de trisodium, Na3Ci, de concentration égale
à 0.036 mol.L-1. Le pH sera celui d' une tribase faible
qui adoptera un comportement de monobase faible de pKb égal à
pKb3, soit 7.60.
On pourra appliquer la formule approchée
des monobases simples:
pH = 7 + 0,5.(6.40 + log 0.036) = 9.48. Comme la valeur
est supérieure à 7.40, soit à pKa3 + 1,
on peut bien appliquer la formule.
Entre les deux valeurs extrêmes il faudra résoudre
l' équation de l' électroneutralité de la solution:

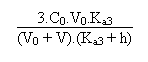
Quatrième partie: au-delà de V/Ve = 3, soit au-delà de V = 120 mL.
C'est la soude en excès qui imposera son pH à
la solution.
On aura:

3. Il se sera formé 8.10-3 mol de citrate de trisodium. La masse de sel qu' on peut espérer recueillir, si le sel ne cristallise pas avec des molécules d' eau, est de 2.064 g.
Exercice IV.16.
Je donnerai peu de détails cette fois. A vous de chercher...
1. La courbe de dosage se découpe en quatre parties.
Première partie: de V/Ve = 0 à V/Ve = 1. Bref, de V = 0 à V = 40 mL.
Le pH initial sera de 9.65.
Lorsque V/Ve = 1 le pH sera de 5.60.
Entre les deux valeurs il faudra résoudre l' équation
d' électroneutralité suivante:
Deuxième partie: entre V/Ve = 1 et V/Ve = 2, soit entre V = 40 et V = 80 mL.
Lorsque V/Ve = 2 le pH de la solution est égal
à 3.95.
Entre les deux valeurs il faudra résoudre l' équation
d' électroneutralité suivante:
Lorsque V/Ve = 3 le pH de la solution vaudra 2.30.
Entre les deux il faudra résoudre l' équation
suivante:
Quatrième partie: au-delà de V/Ve = 3, au-delà de V = 120 mL.
Le pH sera imposé par l'excès d'acide chlorhydrique.
Exercice IV.17.
1. Dans les 100 mL de solution aqueuse on a 8.10-3
mol d' hydroxyde de sodium et 4.10-3 mol de carbonate de disodium.
Il faudra donc un volume V1 d' acide chlorhydrique
de concentration égale à Ca, soit 0.2 mol.L-1,
égal à 60 mL pour neutraliser tous les ions hydroxyde provenant
dela soude, base forte, et pour transformer tous les ions carbonates en
ions hydrogénocarbonates.
Soient les deux réactions suivantes:
Première partie: entre V = 0 et V = 60 mL.
Valeurs extrêmes:
Lorsque V = 0 mL on aura la soude qui imposera son pH
à la solution.
Le pH vaudra alors 12.90, du moins en théorie
(cf erreur alcaline).
Lorsque V = 60 mL le pH sera celui d' une solution aqueuse
d' hydrogénocarbonate de sodium de concentration égale à
0.025 mol.L-1, mélangé à du chlorure de
sodium de concentration égale à 0.05 mol.L-1.
Le pH sera imposé par l' hydrogénocarbonate
de sodium.
On aura un pH qui vaudra 8.35.
Entre les deux valeurs extrêmes, pour V quelconque,
on devra résoudre l' équation d' électroneutralité
suivante:


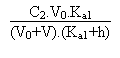
Exercice IV.18.
1. Il y a dans la solution au départ 0.01 mol d'
ions hydroxyde provenant de la soude.
Il faudra 50 mL de solution d' acide chlorhydrique de
concentration égale à 0.2 mol.L-1 pour les neutraliser.
Si l' on verse en tout 70 mL d' acide il y a donc 20
mL qui servent successivement aux passages de l' anion carbonate à
l' anion hydrogénocarbonate, et de l' anion hydrogénocarbonate
au dioxyde de carbone dissous.
Comme les réactions se font dans les proportions
1:1 il y avait 0.002 mol d' anions carbonate dans les 100 mL de solution
initiale.
La concentration en carbonate de disodium est donc égale
à 0.02 mol.L-1.
Retour
au plan du cours sur les pH des solutions aqueuses.
Retour à l' index général de l' ensemble du cours de chimie on line.