I2 + I-![]() I3-
(1)
I3-
(1)
Retour au sommaire des
TP de Chimie.
Retour au sommaire des TP de Chimie.
Manipulation 21: détermination d' une constante d' équilibre par la méthode des coefficients de partage.
E. LANZA et J. MUSSO.
Retour au sommaire des TP de chimie générale.
I. Introduction générale.
On a vu, lors de la manipulation
4, consacrée à l' iodométrie, que le diiode I2,
en solution aqueuse, était très peu soluble, du fait des
interactions de van der WAALS peu favorables à une forte solubilisation
d' une molécule "apolaire" telle que le diiode dans un solvant "polaire"
tel que l' eau.
Afin d' augmenter la solubilité du diiode dans
l' eau on utilise un agent complexant du diiode qui n' est autre que l'
iodure de potassium KI.
Au contact des anions iodure les molécules de
diiode peuvent former l' anion triiodure, I3- selon
la réaction équilibrée:
I2 + I-![]() I3-
(1)
I3-
(1)
Cet équilibre est caractérisé par une constante d' équilibre K équilibre, qu' on écrira:
K équilibre = 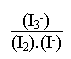
On se propose de déterminer expérimentalement la valeur de cette constante d' équilibre.
Comme il n' est pas possible d' accéder par une méthode simple à la concentration en diiode libre présent à l' équilibre on est obligé d' employer une méthode détournée qui sera basée sur l' étude de coefficients de partage d' une substance donnée entre deux phases liquides non miscibles.
Un coefficient de partage, mais qu' est-ce?
Soit une substance S qui est dissoute dans un solvant
S 1.
Si l' on veut faire passer, pour diverses raisons,
cette substance S dans un solvant S 2, non miscible au précédent,
S 1, il faut procéder à une extraction de S grâce
au solvant S 2. L' opération se déroule en général
dans une ampoule à décanter où sont réunies
deux phases: celle qui contient S et S 1, celle qui, au début,
ne contient que S 2.
En procédant à une extraction (en "agitant"
l' ampoule à décanter) on arrive à faire passer une
quantité de S dans la phase contenant S 2.
Il en résulte, à l' équilibre, que
les concentrations de S dans la phase contenant S 1, (S) S
1 et dans la phase contenant S 2, (S) S 2,
sont proportionnelles à une grandeur notée "q", appelée
coefficient de partage de S entre les solvants S 1 et S 2.
La valeur de q est dépendante de la température
essentiellement et, bien sûr est "spécifique" du tandem "solvant
S 1- solvant S 2".
Philosophie de la manipulation:
La réaction (1) va être réalisée de la manière suivante:
A une solution aqueuse de concentration connue en iodure de potassium KI, on ajoute une solution saturée de diiode I2 dans du tétrachlorure de carbone, CCl4. On agite. Comme le tétrachlorure de carbone et l' eau ne sont pas miscibles entre eux, une partie du diiode I2, solubilisé dans le tétrachlorure de carbone, va passer dans la solution aqueuse d' iodure de potassium. Il en passera autant que nécessaire afin qu' à, la température donnée de l' expérience, l' équilibre de formation de l' anion triiodure I3- puisse s' établir.
La concentration du diiode I2 dans le tétrachlorure de carbone est facilement accessible grâce à un dosage du diiode par le thiosulfate de sodium.
Par le biais de la connaissance, grâce à sa détermination expérimentale, du coefficient de partage "q" du diiode I2 entre une phase aqueuse et le tétrachlorure de carbone il sera alors possible de remonter à la concentration en diiode libre présent dans la phase aqueuse contenant l' iodure de potassium.
II. Manipulation.
Dans l' ordre, préparer les deux solutions suivantes:
1. 20 mL d' une solution de diiode dans le tétrachlorure de carbone, à prélever avec une éprouvette graduée, sous la hotte, avec 200 mL d' eau distillée. Ce sera la solution S 1.
2. 20 mL d' une solution de diiode dans le tétrachlorure de carbone, à prélever avec une éprouvette graduée, sous la hotte, avec 200 mL d' une solution d' iodure de potassium à 0.1 mol.L-1. Ce sera la solution S 2.
Agiter, sous agitation magnétique homogène, les deux solutions durant 10 minutes.
Laisser reposer les solutions durant 30 minutes.
3. Préparer une solution aqueuse de thiosulfate
de sodium de concentration proche de 0.1 mol.L-1.
Déterminer sa concentration exacte. Le thiosulfate
de sodium cristallisé a pour formule: Na2S2O3,5H2O
.
4. Par dilution au cinquième de la solution précédente préparer une solution de thiosulfate de sodium de concentration voisine de 0.02 mol.L-1.
II.1. Détermination du coefficient de partage du diiode, I2, entre le tétrachlorure de carbone, CCl4, et une phase aqueuse.
1. Verser dans l' ampoule à décanter la solution S 1.
Les deux phases, organique et aqueuse, se séparent. La phase organique est en-bas.
Doser séparément un échantillon de 50 mL de phase aqueuse et de 5 mL phase organique par la solution de thiosulfate de sodium à 0.1 mol.L-1.
Pour le dosage de la phase organique, afin de récupérer un maximum de diiode il faut rajouter 10 mL de KI concentré (environ 1 mol.L-1) avant de verser le thiosulfate contenu dans la burette.
Si le volume de solution de thiosulfate de sodium est inférieur à 2 mL à l' équivalence, alors refaire le dosage correspondant avec la solution de thiosulfate de sodium de concentration 0.02 mol.L-1.
II.2. Détermination de la concentration en diiode libre et total à l' équilibre.
Verser dans une seconde ampoule à décanter
la solution S 2.
La phase organique se retrouve au bas de l' ampoule et
les deux phases se séparent parfaitement.
Reprendre à nouveau le dosage de 50 mL de phase aqueuse et de 5 mL de phase organique par la solution aqueuse de thiosulfate de sodium à 0.1 mol.L-1.
Reprendre les dosages avec la solution de thiosulfate diluée au cinquième si le volume de solution de thiosulfate à 0.1 mol.L-1 est inférieur à 2 mL.
III. Résultats.
1. Résultats issus de la première expérience, à savoir les dosages des deux phases de la solution S 1.
On calculera les valeurs des concentrations de diiode I2 dans chacune des phases et l' on déterminera la valeur de q, coefficient de partage du diode entre la phase aqueuse et la phase organique.
q = 
On calculera les concentrations du diiode dans les deux phases, aqueuse et organique.
Dans la phase aqueuse on déterminera la concentration en diiode total.
De la connaissance de q et de celle du diiode dans la phase organique de la solution S 2, déduire la concentration en diiode LIBRE contenu dans la phase aqueuse de S 2.
Déduire alors, à l' équilibre, dans la phase aqueuse de S 2, la concentration en anions triiodure I3-.
Déduire la concentration en anions iodure I- à l' équilibre, dans la phase aqueuse de S 2.
Calculer K équilibre.
Retour sommaire des
TP de chimie générale.
Manipulation 22: loi d' ARRHENIUS. Etude de la variation de la constante de vitesse avec la température.
J. MUSSO et E. LANZA.
Retour au sommaire des TP de Chimie générale.
I. Introduction.
La vitesse des réactions chimiques augmente, en général, avec la température. Plus exactement ce sont les constantes de vitesse k qui elles, augmententent avec la température.
Pour des réactions simples la constante de vitesse k est donnée, avec une bonne approximation, par l' équation d' ARRHENIUS:
k = A. exp (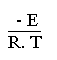 )
(1)
)
(1)
A et E sont des constantes strictement positives. A est la "constante d' action" et E est "l' énergie d' activation" de la réaction. R désigne la constante des gaz parfaits et T la température kelvin de l' expérience.
Sous forme logarithmique cette équation devient:
Ln k = 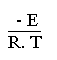 + Ln A (2)
+ Ln A (2)
Par différentiation de cette dernière équation on arrive à:
 =
= 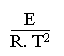
d Ln k = 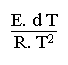
Ln 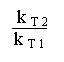 =
=  (3)
(3)
On remarque alors que si les constantes de vitesse k T 2 et k T 1 sont connues grâce à une détermination à deux températures différentes, on peut accéder à la valeur de E, l' énergie d' activation de la réaction.
Dans le cadre de cette manipulation on choisira l' oxydation de l' acide iodhydrique par l' eau oxygénée:
H2O2 + 2 H3O+
+ 2I- ![]() I2
+ 4 H2O
I2
+ 4 H2O
Expérimentalement c' est une réaction du second ordre (ordres partiels égaux à 1 par rapport à chacun des réactifs) qui se produit.
Dans les conditions expérimentales le volume total du mélange reste à peu près constant.
Par réduction du diiode I2 formé avec le thiosulfate de sodium selon:
I2 + 2 S2O32- ![]() 2
I- + S4O62- (4)
2
I- + S4O62- (4)
puis réaction des anions iodure avec l' acide sulfurique présent dans le milieu, on se rend compte que la concentration en acide iodhydrique reste pratiquement constante tout le temps de l' expérience.
Ainsi, la réaction se réduit à une réaction de premier ordre apparent.
Si l' expérience est menée à deux
températures différentes T 1 et T 2,
le rapport des constantes de vitesse 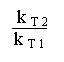 peut être déterminé directement.
peut être déterminé directement.
II. Cinétique du pseudo premier ordre.
L' équation de vitesse pour la réaction du second ordre (ordres partiels égaux à 1 pour chacun des réactifs):
A + B ![]() C
C
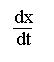 = k"
. (a - x). (b - x)
= k"
. (a - x). (b - x)
L' équation différentielle précédente se réduira à:
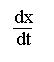 = k".
b. ( a - x)
= k".
b. ( a - x)
k". b = ![]() . Ln
. Ln ![]()
D' où:
k. t = Ln ![]() (5)
(5)
avec k = k". b, où k désigne alors la "constante apparente".
A la température T appliquons la relation (5) au calcul des temps quelconques t 0 et t i .
t 0 = ![]() . Ln
. Ln 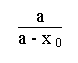
t i = ![]() . Ln
. Ln 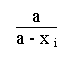
t i - t 0 = ![]() . Ln
. Ln 
t' 0 = ![]() . Ln
. Ln 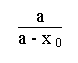
t' i = ![]() . Ln
. Ln 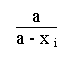
t' i - t' 0 = ![]() . Ln
. Ln 
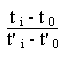 =
= ![]()
III. Mode opératoire.
III.1. Préparation des solutions.
1. Préparer une solution de thiosulfate de sodium à 0.1 mol.L-1, par exemple 100 mL.
2. Préparer une solution aqueuse d' eau oxygénée à 2 volumes, par exemple 100 mL.
3. Dissoudre 2 g d' iodure de potassium KI dans 400 mL d' eau.
III.2. Etude de la réaction à 14° C, soit 287,16 K.
1. Placer 25 mL d' eau oxygénée à 2 volumes dans un tube à essais fermé qu' on porte à 287 K à l' aide du bain thermostatique.
2. Placer la solution d' iodure de potassium préparée en III.1. dans le bain thermostatique.
3. Mélanger 10 mL d' acide sulfurique à 1 mol.L-1 avec 20 mL d' eau distillée et placer ce mélange dans la solution d' iodure de potassium.
4. Attendre 15 minutes.
5. Pendant ce temps, remplir la burette avec la solution de thiosulfate de sodium à 0.1 mol.L-1 et la placer de façon à ce qu' on puisse faire couler son contenu dans l' erlenmeyer réactionnel.
6. Ajouter quelques gouttes de solution d' amidon (ou de thiodène) à la solution d' acide iodhydrique dans l' erlenmeyer et ajouter le contenu du tube à essais. La coloration bleur du complexe diiode-amidon apparaît au bout d' un certain temps.
On prend comme temps initial t 0 l' instant de départ de la réaction entre l' eau oxygénée et l' acide iodhydrique. On déclenche alors le chronomètre. On ne l' arrêtera plus jusqu' à la fin de toute l' expérience.
7. Faire couler un volume connu de thiosulfate de sodium.
En général 1 mL suffit. Lors du premier versement de burette on peut avoir besoin d' un volume allant jusqu' à 3 mL.
Si le thiosulfate est présent en excès alors tout le diiode réagira avec lui et la coloration bleu-marron disparaîtra.
Cette couleur bleue réapparaîtra rapidement à cause de l' oxydation continuelle de l' acide iodhydrique par l' eau oxygénée.
L' instant de réapparition de la coloration bleue est noté t 1.
8. Effectuer une seconde addition de thiosulfate dans l' erlenmeyer. En l' occurence ajouter 1 mL de thiosulfate.
La solution doit se décolorer.
Noter le temps t 2 nécessaire à la réapparition de la couleur bleu-marron.
On répètera l' opération jusqu' à ce qu' on aura versé 10 mL de solution de thiosulfate de sodium.
III.3. Etude de la réaction à 2°C, à savoir 275,16 K.
Répéter l' ensemble des opérations
effectuées en III.2. mais cette fois on se placera à 275,16
K.
IV. Calculs. Exploitation des résultats.
Présenter l' ensemble des résultats sous
la forme suivante:
| Volume de thiosulfate de sodium versé (mL). | Temps mis, depuis l' origine, pour que la solution se recolore ( en
s). Expérience à 275,16 K.
Temps notés " t ' i". |
Temps mis, depuis l' origine, pour que la solution se recolore
( en s). Expérience à 287,16 K.
Temps notés " t i". |
Rapport t i / t' i . |
| 1 | . | . | . |
| 2 | . | . | . |
| 3 | . | . | . |
| 4 | . | . | . |
| 5 | . | . | . |
| 6 | . | . | . |
| 7 | . | . | . |
| 8 | . | . | . |
| 9 | . | . | . |
| 10 | . | . | . |
La valeur moyenne de ces rapports est égale au rapport des constantes k et k'.
( t i / t' i )
moyenne
= ![]()
En déduire la valeur de l' énergie d' activation
E de la réaction (4) , valeur toujours strictement positive
puisqu' il faut fournir cette énergie, donc comptée positivement
au point de vue thermodynamique, pour que la réaction se fasse,
à l' aide de la relation intégrée (3).
On rappelle que R vaut dans le système international
d' unités 8.315 J.K-1.mol-1.
On exprimera la valeur de E en kJ.mol-1.