On cherchera dans ce TP à déterminer la
constante de vitesse apparente k de la réaction d' oxydation des
ions iodure I- en diiode I2, sous l' action d' une
solution aqueuse acidifiée d' eau oxygénée H2O2.
Soit la réaction :
Remarque 1: comment maintient-on la concentration de l' acide iodhydrique constante, ou disons, plus exactement, pratiquement constante?
L' acide iodhydrique initial est produit par action de l' acide sulfurique sur l' iodure de potassium, à savoir la réaction:
Si le volume de thiosulfate ajouté est considéré
comme négligeable devant le volume initial de la solution alors
la concentration en acide iodhydrique est constante.
Si au contraire, et c' est le cas réel, l' ajout
de la solution de thiosulfate de sodium modifie le volume initial alors
cette concentration ne sera pas rigoureusement constante.
Ici, pour simplifier, on considèrera qu' elle reste constante pratiquement.
Remarque 2: rappel de l' écriture de la loi cinétique d' une réaction chimique d' ordre global égal à 1.Application au cas concret de la présente manipulation.
Soit la réaction chimique:
a.A + b.B![]() c.C
+ d.D
c.C
+ d.D
Si l' on peut mettre la vitesse v de réaction sous la forme:
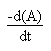
Ln(H2O2)t = Ln(H2O2)0 - k.t
Si l' on note C0 la concentration de l' eau oxygénée et V0 le volume d' eau oxygénée qu' on ajoute au milieu à l' instant initial on a pour nombre de moles initial de H2O2 la quantité suivante: C0.V0.
Le nombre de moles de diiode formé au cours du temps est égal au nombre de moles d' eau oxygénée qui ont disparu.
Le nombre de moles de thiosulfate versé est égal
au double du nombre de moles de diiode formé.
On notera Cthiosulfate et Vthiosulfate
les concentration et volume total versé à l' instant t de
la solution de thiosulfate de sodium.
Le nombre de moles d' eau oxygénée disparu au cours du temps devient alors égal à:
0.5.Cthiosulfate.Vthiosulfate
Le nombre de moles d' eau oxygénée restant présent à l' instant t en solution est alors égal à:
C0.V0 - 0.5.Cthiosulfate.Vthiosulfate
A partir de là, si l' on considère que le volume réactionnel reste pratiquement constant lors de l' expérience on peut simplifier par le volume total de la solution et l' on arrive à l' équation approchée suivante:
Ln(C0.V0 -0.5.Cthiosulfate.Vthiosulfate) = Ln(C0.V0) - k.t
Manipulation proprement dite:
Préparer 100 mL d' une solution aqueuse de thiosulfate
de sodium de concentration Cthiosulfate égale à 0.08 mol.L-1
environ.
Noter la valeur de la masse molaire des cristaux hydratés
sur le flacon.
Noter la valeur exacte de la masse pesée à
la balance de précision.
Calculer la valeur réelle expérimentale
de Cthiosulfate.
Placer la solution aqueuse de thiosulfate de sodium que
vous avez préparée dans la burette.
Peser ensuite une masse d' iodure de potassium KI voisine
de 0.1000 g.
Noter la valeur exacte de la masse pesée.
Placer dans un erlenmeyer:
La masse pesée d' iodure de potassium.
80 mL d' eau déminéralisée ("distillée").
Mesure à l' éprouvette.
10 mL de solution aqueuse d' acide sulfurique à
1 mol.L-1. Mesure à l' éprouvette.
10 gouttes de solution aqueuse d' empois d' amidon.
Le 'turbulent".
Au moment où tout est prêt, où l' on pet déclencher le chronomètre, verser 10 mL de la solution aqueuse d' eau oxygénée dans l' erlenmeyer. Utiliser la pipette.
La solution se colore en marron, ou bleu, suivant la quantité d' empois d' amidon rajoutée.
Déclencher le chronomètre dès la fin de l' agitation. Ne plus l' arrêter jusqu' à la fin de l' expérience.
Verser dès ce moment là 1 mL de solution aqueuse de thiosulfate de sodium. La solution se décolore instantanément.
La solution se recolore à l' instant t1 qu' on note.
On verse rapidement 1 mL supplémentaire de solution
aqueuse de thiosulfate de sodium.
La solution se redécolore rapidement.
La solution se recolore à l' instant t2, qu' on note.
On verse un nouveau mL de solution aqueuse de thiosulfate
de sodium.
Etc...
On note les 15 premières valeurs des temps t i , correspondant au versement des 15 premiers mL de solution aqueuse de thiosulfate de sodium.
On récapitulera tous les résultats dans
le tableau suivant:
| Volume de solution aqueuse de thiosulfate de sodium versé, en mL | Temps, en secondes. | Ln(C0.V0 - 0.5.Cthiosulfate.Vthiosulfate) |
| 1 | ||
| 2 | ||
| 3 | ||
| 4 | ||
| 5 | ||
| 6 | ||
| 7 | ||
| 8 | ||
| 9 | ||
| 10 | ||
| 11 | ||
| 12 | ||
| 13 | ||
| 14 | ||
| 15 |
Tracer à partir des résultats obtenus, sur papier millimétré la courbe suivante:
En déduire la valeur de la pseudo-constante de
vitesse k de la réaction étudiée.
Préciser son unité sachant que le temps
est en secondes.
Comparer le résultat graphique avec le résultat que donne la valeur de k estimée par la méthode mathématique des moindres carrés:

Dans cette formule il y a la somme de 15 termes à
faire au numérateur et autant au dénominateur.
Bon courage!!!!!
Retour au sommaire des
TP de Chimie.
Retour au sommaire des
TP de Chimie.
On se propose d' étudier ici la cinétique d' une réaction de saponification classique, à savoir la saponification de l' éthanoate d' éthyle par l' hydroxyde de sodium:
CH3CO2CH2CH3
+ Na+ + HO- ![]() CH3CO2-
+ Na+ + CH3CH2OH
CH3CO2-
+ Na+ + CH3CH2OH
Cette réaction n' est pas instantanée.
La température est un facteur qui accélère notoirement sa vitesse.
On se propose ici d' étudier la vitesse de cette réaction à la température ambiante, en suivant par une méthode électrique, la variation de la résistance du milieu réactionnel, variation qui est directement fonction des concentrations des diverses espèces ioniques présentes en solution à un instant donné t.
Etude préliminaire des grandeurs qu' on va mesurer:
On a vu en cours de physique que la résistance R d' un matériau conducteur était donnée par la relation suivante:
Avec r qui désigne la "résistivité" du matériau, l la longueur et s la section de ce dernier.
La résistivité est mesurée dans le système international d' unités en W.m.
A partir de là on peut définir la "conductance" L , qui est égale à l' inverse de la résistance R.
Si la résistance R est mesurée en W alors la conductance est mesurée en siemens, symbole S.
On peut définir l' inverse de la résistivité r par s, appelée "conductivité".
Si la résistivité est mesurée en W.m alors la conductivité est mesurée en siemens par mètre, symbole S.m-1.
On appellera K, "constante de cellule" le rapport l/S. Ce rapport caractérise la forme (longueur, section) de la cellule de mesure. Si l est en mètre et S en m2, alors K sera exprimée en m-1.
A partir de là, on arrive à la relation suivante, liant la conductivité s à la conductance L de la solution, ainsi qu' à la constante de cellule K:
Cette méthode électrique a l' avantage de ne pas perturber la composition du milieu réactionnel lors de l' étude.
Etude de la loi cinétique de la réaction précédente.
Lorsqu' on part d' un mélange équimolaire
d' éthanoate d' éthyle et d' hydroxyde de sodium, dans le
cadre d' une réaction d' ordre 2, ce qui est le cas ici, on arrive
à l' équation différentielle suivante, après
avoir posé les conditions initiales et transitoires:
| Ethanoate d' éthyle
CH3CO2CH2CH3 |
Hydroxyde de sodium
Na+ + HO- |
Ethanoate de sodium
CH3CO2- + Na+ |
Ethanol
CH3CH2OH |
|
| t = 0 | C0 mol dans 1 L | C0 mol dans 1 L | 0 mol dans 1 L | 0 mol dans 1 L |
| t = t | C0 - x mol dans 1 L | C0 - x mol dans 1 L | x mol dans 1 L | x mol dans 1 L |
| t = infini | 0 mol dans 1 L | 0 mol dans 1 L | C0 mol dans 1 L | C0 mol dans 1 L |
v = k.(C0 - x)2 = ![]()
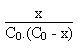
On utilisera les résultats de la loi de KOHLRAUSCH qui, pour tout électrolyte fort, relie la conductivité de la solution aux conductivités limites de chacun des électolytes, ainsi qu' à la concentration de chacun de ces derniers.
s = Sl°i .Ci
Les termes l°i
désignent
les conductivités limites des électrolytes i et Ci leur
concentration respective dans le milieu.
L' unité SI de l°i
est
le siemens.mètre carré.mol-1, symbole S.m2.mol-1.
L' unité SI de Ci est la mole par mètre
cube, symbole mol.m-3.
A t = 0 on aura s(0)
qui vaudra: l°NaOH
.C0
A t = infini on aura s
(infini)
qui vaudra: l°Ethanoate
de sodium .C0
A t = t on aura s
(t) qui vaudra: l°NaOH
.(C0 - x) + l°Ethanoate
de sodium .x
Bien entendu, ni les molécules d' éthanoate
d' éthyle, ni les molécules d' éthanol ne conduisant
le courant électrique, ne figurent pas dans ces formules.
A partir de là on pourra en déduire que:
A t = 0:

L(infini) = ![]()
A t = t:
L(t) = 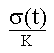


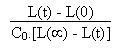
Partie expérimentale:
1. Etalonnage de l' appareil de mesure.
L' étalonnage va se faire à l' aide d' une solution de chlorure de potassium à 0.1 mol.L-1 dont on connaît la conductivité dans la gamme de température où l' on est censé travailler.
On repèrera la température de la salle et des solutions qui vont être utilisées pour l' expérience.
A l' aide du fascicule d' étalonnage de l' appareil on règlera celui-ci de façon à faire coîncider la valeur théorique de la conductivité de la solution étalon avec la valeur affichée par l' appareil.
L' appareil affiche alors une valeur pour la constante de cellule K.
Noter cette valeur et préciser son unité.
Connaissant la relation simple liant L et s, il suffira, moyennant le respect de l' homogénéité des unités, de diviser chaque valeur lue de s par la valeur de K afin d' obtenir L.
Cette opération sera à effectuer 22 fois
lors de ce TP.
Une fois l' étalonnage réalisé, laisser la sonde du conductimètre tremper dans de l' eau distillée.
Attention! Les plaques de la cellule sont fragiles et ne doivent jamais être frottées ni râclées. Un petit coup de pissette d' eau distillée suffit.
2. Préparation des solutions qui permettront de déterminer L(0), L(infini) et L(t).
2.a. Préparation de la solution donnant L(0):
Dans un erlenmeyer mélanger, en utilisant à
chaque fois une pipette:
25 mL d' une solution aqueuse d' hydroxyde de sodium
à 0.05 mol.L-1, 3 fois 25 mL d' eau distillée.
Agiter et lire la valeur de s(0).
Calculer la valeur de L(0).
2.b. Préparation de la solution donnant L(infini):
Cette préparation est à faire en tout début
de séance, toutes affaires cessantes, afin d' économiser
du temps.
Dans un erlenmeyer mélanger, en prenant à
chaque fois une pipette de 25 mL:
25 mL de solution aqueuse d' hydroxyde de sodium à
0.05 mol.L-1, 2 fois 25 mL d' eau distillée, 1 fois 25
mL de solution aqueuse d' éthanoate d' éthyle à 0.05
mol.L-1.
Mettre à chauffer sur la plaque chauffante réglée à 60°C, qui se trouve en salle de TP, pendant 30 minutes.
Passé ce délai refroidir la soultion à
l' aide d' un bain d' eau glacée (mélange eau-glace pilée).
Laisser tremper l' erlenmeyer durant 10 minutes au moins.
Sortir l' erlenmeyer du bain réfrigérant
et le laisser revenir progressivement à la température ambiante.
En fin de séance, après avoir mesuré les 20 déterminations pour L(t), mesurer s(infini).
En déduire la valeur de L(infini).
2.c. Préparation de la solution donnant L(t):
Dans un erlenmeyer, préparer,à l' aide d' une pipette de 25 mL à chaque fois, pendant que la solution donnant L(infini) est sur la plaque chauffante:
25 mL de solution aqueuse d' hydroxyde de sodium à 0.05 mol.L-1; 2 fois 25 mL d' eau distillée.
Lorsque tout est prêt, que l' on peut déclencher le chronomètre pour 1 heure de mesures, rajouter alors, AU TOUT DERNIER MOMENT, 25 mL de solution aqueuse d' éthanoate d' éthyle de concentration égale à 0.05 mol.L-1.
Déclencher alors le chronomètre et lire
toutes les 3 minutes, pendant 1 heure, les valeurs de s(t).
En déduire alors les valeurs de L(t).
Exploitation des résultats:
| temps (minutes) | L(t), en siemens | L(0) - L(t), en siemens | L(t) - L(infini), en siemens | [L(0) - L(t)] / [L(t) - L(infini)] | k |
| 3 | |||||
| 6 | |||||
| 9 | |||||
| 12 | |||||
| 15 | |||||
| 18 | |||||
| 21 | |||||
| 24 | |||||
| 27 | |||||
| 30 | |||||
| 33 | |||||
| 36 | |||||
| 39 | |||||
| 42 | |||||
| 45 | |||||
| 48 | |||||
| 51 | |||||
| 54 | |||||
| 57 | |||||
| 60 |
Faire très attention à la valeur que vous donnerez à C0. Ne pas oublier le facteur de dilution.
Tracer sur papier millimétré la courbe donnant L(t) en fonction de t.
Calculer à partir de la courbe le temps de demi-réaction t 0.5.
Démontrer qu' on a alors la relation suivante:
Tracer sur une autre feuille de papier millimétré
la courbe donnant L(t) en fonction de 
L' équation de la courbe est celle d' une
fonction affine.
Déterminer les valeurs théoriques de l' ordonnée à l' origine et de la pente (coefficient directeur) en fonction des données en début de TP.
En déduire la valeur de k. Donner son unité.
Comparer cette valeur de k à la valeur moyenne de k trouvée à partir des 20 mesures consignées dans le tableau.
Comparer cette valeur de k à celle trouvée à partir de temps de demi-réaction.
Commentaires éventuels.
Ouf, c' est fini.
Il était bien celui-là non?
Retour au sommaire des TP de Chimie.
Retour au sommaire des TP de Chimie.
La loi de RAOULT relative à la cryométrie.
Le chimiste français RAOULT, s' est rendu compte,
au XIX° siècle, en étudiant les solutions de composés
de masses molaires connues, que l' abaissement de la température
de congélation d' un solvant donné est proportionnelle au
nombre de moles de soluté dissous dans ce solvant. C' est ce qu'
on appelle les propriétés "colligatives" du corps dissous.
RAOULT a remarqué alors que le même nombre
de moles de divers solutés dissous dans la même masse de solvant
entraînait le même abaissement de température de congélation.
Effectuer des mesures de "cryométrie" revient donc à comparer la température de congélation d' un solvant pur à celles du même solvant contenant diverses masses de solutés divers, dissous séparément , dans ce solvant.
L' énoncé de la loi de RAOULT pour la cryométrie est le suivant:
L' abaissement de la température de congélation d' un solvant est proportionnel au nombre de moles de soluté et inversement proportionnel à la masse du solvant.
On peut alors formuler cette loi de la façon suivante:
C' est par exemple l' utilisation de cette loi physique qui permet de démonter que l' acide éthanoïque CH3CO2H se présente sous la forme de dimères CH3CO--OH -----OCHOCH3 lorsqu' il est mis en solution dans des solvants polaires mais aprotiques. C' est l' existence de liaisons intermoléculaires de type hydrogène ( interactions fortes de type Van der WAALS) qui explique cela. La masse molaire mesurée par cryométrie est égale alors au double de la masse molaire de l' acide éthanoïque.
Manipulation proprement dite:
Partie 1. Détermination de la température de congélation du solvant pur, en l' occurence l' eau.
Verser dans un tube à essais, parfaitement sec
sur sa face externe, environ 3 cm de hauteur d' eau distillée.
Placer le tube dans le manchon de verre.
Placer l' ensemble dans le bain réfrigéré.
Mettre en route l' agitation et déclencher le
chronomètre.
Enregistrer la courbe de congélation de l' eau pure T = f (t).
Attention! Un phénomène parasitaire de retard à la cristallisation peut survenir au voisinage de la température de congélation. Ce phénomène imprévisible se nomme "surfusion".
Le liquide reste alors à l' état liquide alors que théoriquement il aurait dû commencer à passer à l' état solide. Il faut alors en général laisser la température du tube à essais continuer de descendre d' environ trois degrés et "tapoter" ensuite légèrement le tube. On constate alors une remontée "fulgurante" de la température et celle-ci rejoint alors la température normale de congélation.
On arrêtera d' enregistrer la température
de congélation du solvant lorsque la température se sera
stabilisée au palier de congélation.
On est alors en présence d' un équilibre
entre deux phases: l' eau liquide et la glace. Tant qu' il reste de l'
eau liquide en présence de glace la température se stabilise
à la température de congélation du solvant.
On n' enregistrera donc pas la température de refroidissement de la glace au cours du temps, à savoir la troisième partie de la courbe T = f(t).
Noter la température de congélation de l' eau.
Partie 2: détermination de la constante cryométrique de l' eau.
Reprendre la même expérience que précédemment mais remplacer l' eau pure par une solution aqueuse d' urée CO(NH2)2, de masse molaire égale à 60 g.mol-1, à 30 g.L-1 dans l' eau.
Enregistrer la courbe de congélation de l' urée en solution aqueuse.
Noter la température de congélation du mélange urée-eau.
En déduire la valeur de la constante cryométrique K de l' eau. Préciser son unité dans les unités arbitraires qui ont été choisies ici.
Partie 3: détermination de la masse molaire d' un composé inconnu X.
Reprendre la même expérience que précédemment mais remplacer la solution étalon d' urée par une solution aqueuse d' un composé X, de masse molaire MX, à 171.15 g.L-1 dans l' eau.
Enregistrer la température de congélation de la solution inconnue en fonction du temps.
Noter la température de congélation du mélange.
En déduire la valeur de la masse molaire MX du soluté inconnu.
Sachant que ce soluté est composé de carbone, d'oxygène et d' hydrogène, et que son analyse centésimale massique a donné les valeurs suivantes:
Carbone: 42.10%.
Oxygène: 51.47%.
Hydrogène: 6.43%.
Peut-on trouver sa formule brute?
Qui est-ce?