Suite du cours d' atomistique:
la théorie des orbitales moléculaires.
Retour
au plan du cours d' atomistique.
Cette théorie a été développée
dans le courant des années 1930, suite, notamment, aux travaux d'
Erwin SCHRÖDINGER.
Elle est apparue nécessaire car, ni la théorie
de LEWIS, ni la théorie de l' hybridation (ou de la liaison de valence)
ne permettaient de décrire convenablement le comportement de molécules,
parfois simples, telles que le dioxygène O2.
Principes de la théorie des orbitales moléculaires.
On commencera par l' atome d' hydrogène, le plus
simple des éléments chimiques, et on étudiera, à
partir de là, la formation de la molécule de dihydrogène
H2.
L' équation de SCHRÖDINGER a donné,
on l' a vu, comme solution décrivant le comportement de l'
électron unique de l' atome d' hydrogène, dans son état
fondamental, la fonction d' onde Y 1s.
La forme mathématique de cette fonction d' onde
est, rappelons-le, la suivante:
Partie radiale
R(r) |
Partie angulaire
Q(q).F(f) |
| 2.(Z/a0)1.5.exp(-Z.r/a0) |
1/[2.(p)0.5] |
Ici, dans le cas de l' hydrogène, Z vaut 1 et a0
désigne le rayon de la première orbite de BOHR, à
savoir 0.53 angström.
On remarquera une indépendance vis-à-vis
de q et de f.
On remarquera à nouveau que le signe de Y
est donné par celui de la partie radiale R(r). Le signe est évidemment
positif puisque l' exponentielle est toujours positive.
A partir de là on va construire la molécule
de dihydrogène H2 en utilisant une combinaison linéaire
(opération purement mathématique) des orbitales Y1s
de l' atome d' hydrogène "numéro 1" et de l' atome d' hydrogène
"numéro 2" de la future molécule.
La combinaison linéaire des orbitales atomiques
conduira à une "orbitale moléculaire".
Cette théorie est appelée de façon
abrégée en français "C.L.O.A"., c' est à dire
"combinaison linéaire des orbitales atomiques" et, en anglais "L.C.A.O.",
c' est à dire "linear combination of atomic orbitals".
Il y aura, en fait, deux façons de combiner
ces orbitales atomiques: une façon "constructive", qu' on appellera
"liante", et une façon "destructrice", qu' on appellera "antiliante":
1. Façon "liante" de combiner les orbitales atomiques
Y1s
de deux atomes d' hydrogène:
Y moléculaire "liante"
= A.Y1s (atome 1) + B.Y1s
(atome 2)
Avec A et B qui sont deux constantes de normalisation
de la fonction Y moléculaire "liante",
de façon à ce que Y2
moléculaire "liante" soit, lorsqu' on intègre sur tout l'
espace, égale à l' unité, c' est à dire avoir
100% de chances de trouver les électrons de liaison dans tout l'
espace.
A et B sont positives. On "additionne" dans la façon
"liante" les deux fonctions d' onde Y1s
qui sont positives toutes les deux.
2. Façon "antiliante" de combiner les orbitales
atomiques Y1s de deux atomes d' hydrogène:
Y moléculaire "antiliante"
= A.Y1s (atome 1) - B.Y1s
(atome 2)
A et B sont les mêmes constantes de normalisation
que précédemment, lors de la combinaison linéaire
"liante", mais on remarquera le signe moins entre les deux termes.
La fonction d' onde Y1s
étant positive on constate ici qu' on enlève une partie négative,
en l' occurence -B.Y1s (atome 2)
à une partie positive, en l' occurence A.Y1s
(atome 1).
A partir de là on établira un diagramme
énergétique des orbitales moléculaires de la molécule
de dihydrogène:
O.A.
Orbitales atomiques de l' atome d' hydrogène numéro 1. |
O.M.
Orbitales moléculaires de la molécule de dihydrogène,
H2. |
O.A.
Orbitales atomiques de l' atome d' hydrogène numéro 2. |
Sens croissant des énergies
 |
| . |
____
Orbitale moléculaire antiliante |
. |
. |
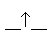 |
. |
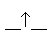 |
. |
| . |
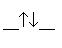
Orbitale moléculaire liante |
. |
. |